
【题目】催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:

已知反应aA(g)+bB(g)![]() gG(g)+hH(g)的标准平衡常数Kθ=
gG(g)+hH(g)的标准平衡常数Kθ=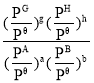 ,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
(1)在绝热恒容的密闭容器中,能表明反应2SO2(g)+O2(g)![]() 2SO3(g)已达到平衡状态的是___。
2SO3(g)已达到平衡状态的是___。
A.v(SO2)=2v(O2)
B.当容器内温度不再变化时
C.各组分的物质的量相等
D.容器内气体密度不变
E.混合气体的平均相对分子质量不变
(2)在1000℃时随着O2物质的量的增大,但SO2平衡转化率升高缓慢,其原因是___。
(3)求图1中a点的标准平衡常数Kθ=___。在a点达到平衡后,若保持温度、压强不变,再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,此时v(正)___v(逆)(填“<”“>”或“=”)。
(4)若在相同的恒容密闭容器中充入O2和SO2各2mol,在不同温度下达到平衡,反应体系总压强随时间变化如图2所示,则达到平衡状态b和c时,SO3体积分数较大的是___(填“b”或“c”),原因是___。
【答案】BE 1000℃时,该反应平衡常数很小,SO2平衡转化率的变化很小 176 > c 起始b压强大于c说明b温度高于c,该反应是放热反应,温度越低平衡时SO3的体积分数越大
【解析】
(1)根据平衡状态的本质及特征分析解答;
(2)根据温度对平衡常数及平衡移动方向的影响分析解答;
(3)根据题给信息中平衡常数的表达式计算平衡常数,判断平衡移动方向;
(4)实验b到达平衡时总压强变大,说明平衡逆向移动,而化学反应速率变大,考虑到该反应是放热反应,可能是升高温度所导致。
(1)A. v(SO2)=2v(O2)并未体现正反应速率与逆反应速率的相对大小,不能说明反应已经达到平衡,故A不选;
B. 该容器为绝热容器,当容器内温度不再变化时,说明正反应速率等于逆反应速率,能说明反应已经达到平衡,故B选;
C. 各组分的物质的量相等不能说明各组分的浓度不再变化,也就不能说明反应达到平衡,故C不选;
D. 容器体积不变,且反应前后气体质量不变,所以容器内气体密度始终不变,不能说明反应达到平衡,故D不选;
E. 反应前后气体总质量不变,反应前后气体的总物质的量不相等,则混合气体的平均相对分子质量不变时,说明各组分的浓度不变,能说明反应已经达到平衡,故E选,故答案为:BE;
(2)2SO2(g)+O2(g)2SO3(g)△H<0,温度达到1000℃时该反应的平衡常数很小,使二氧化硫的平衡转化率小,在1000℃时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减小,c(O2)增大,Qc=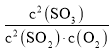 <K,平衡正向移动,二氧化硫的平衡转化率增大,但变化很小,故答案为:1000℃时,该反应平衡常数很小,SO2平衡转化率的变化很小;
<K,平衡正向移动,二氧化硫的平衡转化率增大,但变化很小,故答案为:1000℃时,该反应平衡常数很小,SO2平衡转化率的变化很小;
(3)a点达到平衡时,SO2的物质的量为2mol×(1-80%)=0.4mol,则
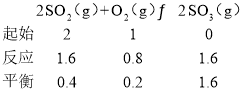
SO2,O2,SO3的分压分别为:1.01×105Pa×![]() =1.01×105Pa×
=1.01×105Pa×![]() 、1.01×105Pa×
、1.01×105Pa×![]() 、1.01×105Pa×
、1.01×105Pa×![]() ,则Kθ=
,则Kθ=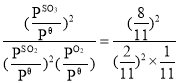 =176;再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,SO2,O2,SO3的分压分别为:1.01×105Pa×
=176;再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,SO2,O2,SO3的分压分别为:1.01×105Pa×![]() =1.01×105Pa×
=1.01×105Pa×![]() 、1.01×105Pa×
、1.01×105Pa×![]() 、1.01×105Pa×
、1.01×105Pa×![]() ,Qp=
,Qp=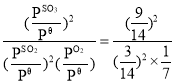 =63<Kθ,平衡向正向移动,v(正) >v(逆),故答案为:176;>;
=63<Kθ,平衡向正向移动,v(正) >v(逆),故答案为:176;>;
(4)如图所示,达到平衡状态b和c时,SO3体积分数较大的是c;原因是起始b压强大于c说明b温度高于c,该反应是放热反应,温度越低平衡时SO3的体积分数越大,故答案为:c;起始b压强大于c说明b温度高于c,该反应是放热反应,温度越低平衡时SO3的体积分数越大。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
A.方案①用于分离I2和NH4I固体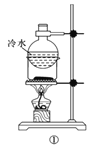
B.方案②用于比较CuSO4和MnO2的催化活性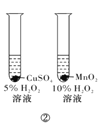
C.方案③用于测定中和热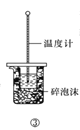
D.方案④用于比较醋酸和硼酸的酸性强弱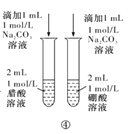
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、NH4+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol/L.往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
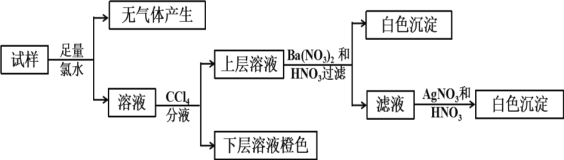
A.Ba2+、Fe3+、SO42-、CO32-肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含SO42-和SO32-
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含NH4+需另做实验判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题。

(1)② 表示的元素是______(填元素符号);
(2)①、⑤两种元素的原子半径大小为②______⑤(填“< ”或“>”);
(3)⑤所在元素周期表中的位置是_____________;
(4)写出③与⑥两种元素所形成化合物的化学式_________;
(5)④所表示元素的单质与③所表示元素的最高价氧化物的水化物在溶液中反应的离子方程式为:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol/LNa2CO3溶液中逐滴加入20mL0.1mol/L的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
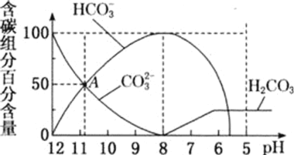
A.HCl溶液滴加一半即10mL时,溶液pH>7
B.0.1mol/LNa2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-)
C.在A点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.当pH=5时,溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2+3H22NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A.v(H2)=0.03mol/(L·min)
B.v(N2)=0.02mol/(L·min)
C.v(NH3)=0.17mol/(L·min )
D.v(NH3)=0.01mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:
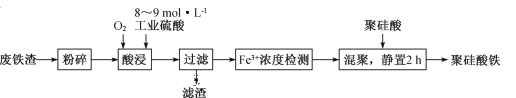
(1)废铁渣进行“粉碎”的目的是______________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如图所示。

①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_____________。
②酸浸时,通入O2的目的是__________。
③当酸浸温度超过100 ℃时,铁浸取率反而减小,其原因是____________。
(3)滤渣的主要成分为____________(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________。
(2)该反应为______反应(选填吸热、放热)。
升高温度CO2的转化将____________(填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是______(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42-)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为____。
A.在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中
B.在搅拌下,将KClO饱和溶液缓慢滴加到Fe(NO3)3饱和溶液中
C.在搅拌下,将KClO饱和溶液和Fe(NO3)3饱和溶液一起加入
反应的离子方程式为______________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>____。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.100 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程)______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com