
【题目】短周期主族元素W、X、Y、Z在元素周期表中的位置关系如图,其中X是短周期中原子半径最大的金属元素,Y的单质在常温下为淡黄色固体,下列有关说法正确的是

A. Y的简单氢化物的热稳定性比W、Z的都强
B. 四种元素的简单离子具有相同的电子层结构
C. X的氧化物结构中阴阳离子之比为1:2
D. Y的最高价氧化物对应水化物的酸性比Z的强
【答案】C
【解析】短周期主族元素W、X、Y、Z,其中X是短周期中原子半径最大的金属元素,则X为Na元素;Y的单质在常温下为淡黄色固体,Y为S元素,则W为O元素,Z为Cl元素。A. 同主族从上到下,非金属性减弱,则对应氢化物的稳定性减弱,同周期从左向右,非金属性增强,则对应氢化物的稳定性增强,Y的简单氢化物的热稳定性比W、Z的都弱,故A错误;B. O和Na的简单离子具有相同的电子层结构,都是2,8排布,S和Cl的简单离子具有相同的电子层结构,都是2,8,8排布,故B错误;C. X的氧化物无论是氧化钠,还是过氧化钠,阴阳离子之比都为1:2,故C正确;D.同周期从左向右,非金属性增强,则最高价含氧酸的酸性增强,Y的最高价氧化物对应水化物的酸性比Z的弱,故D错误;故选C。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】实验室用锌粒与2mol/L硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
A.用锌粉代替锌粒B.滴入几滴硫酸铜溶液
C.改用5mol/L硫酸溶液D.改用冷的2mol/L硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列有关叙述正确的是
A. 46g乙醇与甲酸混合物中,含有的氧原子数为NA
B. 1L0.1mol/L的CH3COONa溶液中,Na+数为0.1NA
C. 标准状况下,5.6LNO和O2的混合气体中含有的分子数为0.25NA
D. 常温下,14g铁皮与足量浓硝酸反应,转移的电子数为0.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是()
A. 偏二甲肼(C2H8N2)的摩尔质量为60g
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C. 1mol偏二甲肼(C2H8N2)的质量为60g/mol
D. 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
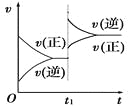
A. A、B、C是气体,D不是气体
B. A、B是气体,C、D有一种是气体
C. C、D是气体,A、B有一种是气体
D. C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。回答下列问题:
(1)已知:①1g H2 完全燃烧生成H2O(g)放出121kJ 的热量;
②N2(g) +O2(g)==2NO(g) △H =+180.5kJ·mol-1
③4NH3(g) +5O2(g)==4NO(g) +6H2O(g) △H =-906.2kJ·mol-1
工业合成氨的热化学方程式是_________________________________________。
(2)应用化石燃料(特别是煤)制备的原料气H2 中含有杂质碳( 主要成分为CO2)、杂质硫主要成分为H2S)。工业上采用湿法脱硫的方法回收硫,方法是先用纯碱溶液吸收H2S,使之转化为NaHS,然后用偏钒酸钠(NaVO3)溶液氧化硫元素,使之转化为硫单质,并生成焦钒酸钠( Na2V4O9),混法脱硫中发生的氧化还原反应的化学方程式是_________________________,反应中转移2×103mol电子时,理论上回收硫_______kg。
(3)工业上利用NH3为原料合成尿素,其原理是2 NH3(g) +CO2(g)![]() CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
合成尿素的反应为_____________(填“放热反应”或“吸热反应”)。
②合成尿素的原料气中NH3和CO2的物质的量之比称为氨碳比,可用[n(NH3)]/[n(CO2)]表示。在一定温度和压强下,图甲中曲线________(填“I”或“II”)表示的是氨碳比与CO2的转化率(a)的关系,判断理由是_______________________________;当[n(NH3)]/[n(CO2)]=4时,NH3的转化率为_______________。

(4)利用特殊的材料,通过电化学法也可以合成氨,如图乙所示原理可利用N2、H2、CO、水蒸气合成氨。阳极反应式是_______________,离子交换膜中通过的离子是_____(填化学符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )

A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,将同种规格的铝片分别投入下列物质中,生成氢气的反应速率最大的是( )
A.0.1mol/L盐酸15mL
B.0.2mol/L盐酸12mL
C.0.15mol/L硫酸8mL
D.18mol/L硫酸15mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com