
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | IB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________,M2+的核外电子排布式为________________________。
(2)M2Z的熔点比M2W的_________(填“高”或“低”) ,请解释原因___________ 。
(3)N3-和YZ2是等电子体,则N3-的结构式为_________________ 。
(4)WZ2分子中W原子价层电子对数是_____________对,WZ2的VSEPR 模型名称为______________________,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________;WZ3的三聚体环状结构如图1所示,该结构中W原子的杂化轨道类型为__________;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________(填图2中字母) ,该分子中含有___个σ键。
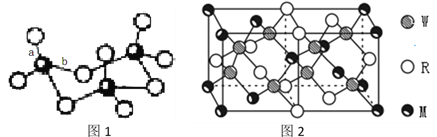
(5)MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与_______个W原子相连,晶体密度ρ=_______g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023mol-1)。
【答案】 O [Ar]3d9 高 氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高 [N=N=N]- 3 平面三角形 sp2 sp3 a 12 4 ![]()
【解析】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大。Y的原子核外有6个不同运动状态的电子,Y为C元素; Z 是非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同,Z的电子排布式为1s22s22p4,为O元素;W是主族元素,与Z原子的价电子数相同 ,W为S元素;R 的价层电子排布式为3d64s2,R为Fe元素;M位于第IB族,其被称作“电器工业的主角”,为Cu元素。
(1)因为Z为O、W为S,非金属性为O>S,所以第一电离能是O>S,M为Cu元素,为29号元素,Cu2+的核外电子排布式为[Ar]3d9。
(2)由上述分析知M2Z的化学式为Cu2O,M2W的化学式为Cu2S。因为氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高。答案:高;氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高 。
(3由上述分析知YZ2的化学式为CO2, N3-是CO2的等电子体,所以N3-的结构式为[N=N=N]-。
(4)WZ2的分子式为SO2, SO2中W原子价层电子对数是中心原子的孤对电子对数和![]() 键电子对数之和,中心原子的孤对电子对数=(6-2
键电子对数之和,中心原子的孤对电子对数=(6-2![]() )/2=1
)/2=1![]() 键电子对数为2,所以S原子价层电子对数是3对。SO2的VSEPR 模型名称为平面三角形。SO3气态为单分子,该分子中S原子形成3个δ键,没有孤对电子,则为sp2杂化,SO3的三聚体中S原子形成4个δ键,为sp3杂化;SO3的三聚体中每个S形成S=O键和S-O键,S=O键长较短,即a较短,该分子中含有σ键数目为3×4=12。
键电子对数为2,所以S原子价层电子对数是3对。SO2的VSEPR 模型名称为平面三角形。SO3气态为单分子,该分子中S原子形成3个δ键,没有孤对电子,则为sp2杂化,SO3的三聚体中S原子形成4个δ键,为sp3杂化;SO3的三聚体中每个S形成S=O键和S-O键,S=O键长较短,即a较短,该分子中含有σ键数目为3×4=12。
(5)由图知每个Cu原子和4个S原子相连,S均在体内,由此知化学式为CuFeS2,则含晶胞质量为![]() ,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=
,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=![]() =
=![]() =
= gcm-3,故答案为:4;
gcm-3,故答案为:4;
![]()


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 __________________。
(2)B的最高价氧化物化学式为____________,C的元素名称为 ___________________ 。
(3)D的单质与水反应的方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。
CoCl2+xH2O![]() CoCl2·xH2O
CoCl2·xH2O
深蓝色 粉红色
现有65 g无水CoCl2,吸水后变成CoCl2·xH2O 119 g。
(1)水合物中x=________。
(2)若该化合物中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-的个数比为1∶1,则其化学式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
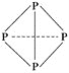
【题目】“三鹿奶粉事件”在社会上引起了人们对食品质量的恐慌,三鹿奶粉中被掺杂了被称为“蛋白精”的工业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题:

(1)写出基态碳原子的电子排布式______________。
(2)氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是__________、__________、__________。
(3)一个三聚氰胺分子中有______个σ键。
(4)三聚氰胺与三聚氰酸(![]() )分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取________杂化。该分子的结构简式中,每个碳氧原子之间的共价键是__________(填选项)。
)分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取________杂化。该分子的结构简式中,每个碳氧原子之间的共价键是__________(填选项)。
A.2个σ键 B.2个π键 C.1个σ键,1个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A.蒸发使用的主要仪器是蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台
B.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.丁达尔效应可以鉴别胶体和溶液
D.用规格为10 mL的量筒量取6.20 mL的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷分子中P—P键易断开,若一个白磷分子中每个P—P键均断开插入一个氧原子,则一共可结合________个氧原子,这样得到磷的一种氧化物,其分子式为________。由C、H、N三种元素组成的某化合物,其分子内含4个氮原子,且4个氮原子排成内空的正四面体(同白磷),每两个氮原子间都有一个碳原子,且分子内无C—C和C===C,则化合物的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应:xR2++Cl2=yR3++zCl-的说法中正确的是( )
A.x=y,R2+得到电子
B.x=2, Cl2作氧化剂
C.y=z,R3+是还原产物
D.x=z, Cl-是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习了氯气的相关知识之后,某化学兴趣小组用下图所示仪器及试剂,进行了实验室制取氯气实验,并探究其相关化学性质。
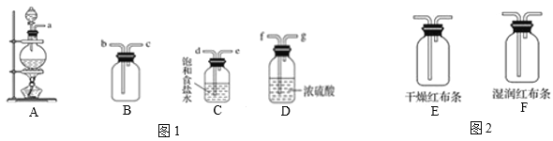
(1)若A中药品为MnO2和浓盐酸,请写出实验原理_____________________(用化学方程式表示)。
(2)将图1各仪器按先后顺序连接起来___________(用导管口处的字母表示)。
(3)C装置的作用_____________________。
(4)验满的方法为_____________________。
(5)把Cl2分别通入图2装置E和F,可以观察到什么现象______________________________;实验目的:_____________________。
(6)实验室除了可以用MnO2和浓盐酸制取Cl2,还可以用哪些药品与浓盐酸反应制取_______________________(用化学方程式表示其反应原理)
(7)该实验有哪些不足之处_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com