

| n(NH3) | n(CO2) |
| 1 |
| 2 |
| ||
| ||
| ||
| �� |
| ���� |
| ���� |
| ||
| �� |
| ���� |
| ���� |
| (0.9x)2 |
| 0.1x��(y-0.9x) |
| y |
| X |
| 1 |
| 2 |
 ��
�� ��
��
| ||
| ||
| 1.2a |
| 4a |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
c(N
| ||
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����
�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ���и��������������ۻ�ѧ�Ծ��������棩 ���ͣ������
��Ԫ�ؼ��仯�����ڹ�����ѧ��������������ҪӦ�á�
��1��д��ʵ������NH3�Ļ�ѧ��Ӧ����ʽ������������������������������???????????
��2����ҵ�ϳɰ���ԭ���ǵ����������������Ǵӿ����з�������ģ���������Դ��ˮ��̼�⻯���д������Ȼ��Ϊԭ����ȡ�����Ļ�ѧ��Ӧ����ʽ����������?? ������������������
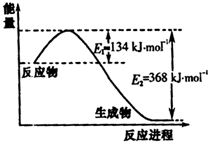
��3���ںϳɰ���ԭ�����Ʊ������л���CO�Դ����ж������ã�����ȥԭ�����е�CO����ͨ�����·�Ӧ��ʵ�֣�CO(g)+H2O(g) CO2 (g)+ H2 (g) ��H��0����Ӧ�ﵽƽ���Ϊ���CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ������������???????????????????????????? ������֪1000Kʱ�÷�Ӧ��ƽ�ⳣ��K=0.627����ҪʹCO��ת���ʳ���90%������ʼ���У�c(H2O)�sc(CO)��������������������
CO2 (g)+ H2 (g) ��H��0����Ӧ�ﵽƽ���Ϊ���CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ������������???????????????????????????? ������֪1000Kʱ�÷�Ӧ��ƽ�ⳣ��K=0.627����ҪʹCO��ת���ʳ���90%������ʼ���У�c(H2O)�sc(CO)��������������������
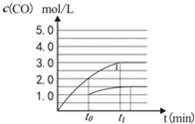
��4�����ݻ�Ϊ2L�����з�����ӦCO(g)+H2O(g) CO2 (g)+ H2 (g)����֪c(CO)�뷴Ӧʱ��t�仯������
CO2 (g)+ H2 (g)����֪c(CO)�뷴Ӧʱ��t�仯������

����t0ʱ�̽����������������4L�����ڴ��ͼ�л��c(CO)�뷴Ӧʱ��t�仯������

��5����ҵ������CO(NH2)2��CO2��NH3��һ�������ºϳɣ��仯ѧ��Ӧ����ʽΪ����������������
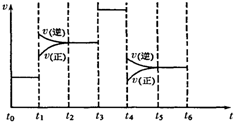
��6���ϳ�����ʱ������̼�� =4��CO2��ת������ʱ��ı仯��ϵ����ͼ��ʾ��
=4��CO2��ת������ʱ��ı仯��ϵ����ͼ��ʾ��
����A����淴Ӧ����v��(CO2)�� B�������Ӧ����Ϊv��(CO2)����������������������������
����NH3��ƽ��ת����Ϊ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���Ϻ���������������ѧ���������л�ѧ�Ծ��������棩 ���ͣ������
��Ԫ�صĻ������ڹ�ũҵ�Լ������Ƽ�����;�㷺����Ҳ��Ի��������Ⱦ�������ˮ����������ɵĵ���Ⱦ�ѳ�Ϊһ�������ԵĻ������⡣
���������գ�
��1��ij������ģ�����ˮ�ѵ����̣�����Fe�ۺ�KNO3(aq)��Ӧ̽���ѵ�ԭ����ʵ��ǰ
����0.1mol��L-1H2SO4(aq)ϴ��Fe�ۣ���Ŀ���� ��Ȼ��������ˮϴ�������ԣ�
�ڽ�KNO3(aq)��pH����2.5��
��Ϊ��ֹ�����е� ��д��ѧʽ�����ѵ���Ӱ�죬Ӧ��KNO3��Һ��ͨ��N2��
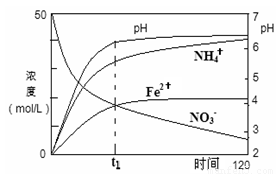
��2��������Fe�ۻ�ԭ����KNO3(aq)�����У���Ӧ���������������Ũ�ȡ�pH��ʱ��ı仯��ϵ��ͼ��ʾ�������ͼ����Ϣд��t1ʱ��ǰ�÷�Ӧ�����ӷ���ʽ�� ��
��3���������˷ɴ��Ļ���ƽ����г����£�N2H4����ȼ�ϡ�NH3��NaClO��Ӧ�ɵõ��£�N2H4�����÷�Ӧ�б������뱻��ԭ��Ԫ�ص�ԭ�Ӹ���֮��Ϊ �������Ӧ����5mol���ӷ���ת�ƣ��ɵõ��� g��
��4����������25mL 0.01mol/Lϡ�����л���ͨ��5.6 mL NH3����״������Һ����仯���Բ��ƣ�����Ӧ����Һ������Ũ���ɴ�С��˳���� ����ͨ��NH3�Ĺ�������Һ�ĵ������� ����д���������С���������䡱����
��5����������Һ�м���ͨ��NH3���ù���������Ũ�ȴ�С��ϵ������ȷ���� ��ѡ���ţ���
a��c(Cl-)=c(NH4+)��c(H+)=c(OH-) b��c(Cl-)��c(NH4+)=c(H+)��c(OH-)
c��c(NH4+)��c(OH-)��c(Cl-)��c(H+) d��c(OH-)��c(NH4+)��c(H+)��c(Cl-)
��6����������25mL��HCl 0.01mol����Һ�еμӰ�ˮ���������ù�����ˮ�ĵ���ƽ�� ����д����ƽ���ƶ�����������μӰ�ˮ��25mLʱ�������Һ��ˮ�ĵ���������ˮ��Ũ��Ϊ mol��L-1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com