
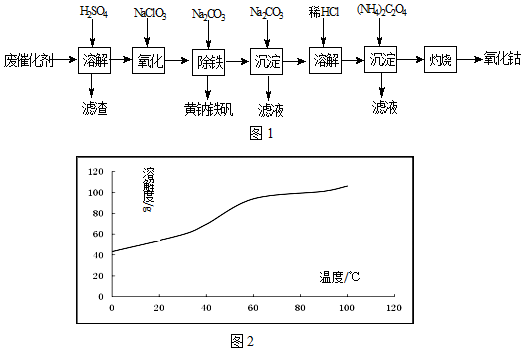
分析 钴废催化剂加入稀硫酸,发生Co+H2SO4=CoSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,过滤滤渣是不溶的二氧化硅,而滤液是硫酸钴、硫酸亚铁与过量的硫酸的混合溶液,向滤液中加氯酸钠将亚铁离子氧化成铁离子,然后加入碳酸钠得到黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,继续向滤液中加入碳酸钠,得到碱式碳酸钴[(CoCO3)2•3Co(OH)2],然后用盐酸溶解碱式碳酸钴[(CoCO3)2•3Co(OH)2],再向所到溶液中加入草酸铵,得到溶解度极小的草酸钴,最后燃烧生成氧化钴;
(1)洗液与滤液合并,提高洗涤和滤液中钴的利用率;
(2)亚铁离子被氯酸根离子氧化成铁离子,根据得失电子守恒分析解答;根据3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀);4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀),如果亚铁离子部分氧化,滴加无色的硫氰化钾生成蓝色沉淀,可向氧化后的溶液中滴入硫氰化钾,观察是否有蓝色沉淀生成;
(3)生成硫酸铁与碳酸钠发生双水解得到黄钠铁矾,书写化学方程式;
(4)沉淀洗涤的方法是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次;
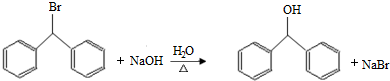
(5)CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低氯化钴析出;
(6)CoC2O4的质量为1.470g,其我知道可为0.01mol,Co元素质量为0.59g,钴氧化物质量为0.83g,氧化物中氧元素质量为0.83g-0.59g=0.24g,则氧化物中Co原子与O原子物质的量之比为0.01mol:$\frac{0.24}{16}$≈2:3,故Co氧化物为Co2O3;
解答 解:(1)洗液与滤液合并,提高洗涤和滤液中钴的利用率,故答案为:提高钴等元素的利用率;
(2)亚铁离子被氯酸根离子氧化成铁离子,1molr的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O,取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化,故选A,
故答案为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O;A;
(3)生成硫酸铁与碳酸钠发生双水解得到黄钠铁矾,化学反应方程式为:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑,故答案为:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑;
(4)沉淀洗涤的方法是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次,
故答案为:向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次;
(5)CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低氯化钴析出,故答案为:防止因温度降低,CoCl2晶体析出;
(6)CoC2O4的质量为1.470g,其我知道可为0.01mol,Co元素质量为0.59g,钴氧化物质量为0.83g,氧化物中氧元素质量为0.83g-0.59g=0.24g,则氧化物中Co原子与O原子物质的量之比为0.01mol:$\frac{0.24}{16}$≈2:3,故Co氧化物为Co2O3,故答案为:Co2O3.
点评 本题考查化学方程的书写、离子的检验、沉淀的洗涤、对图象的分析处理等,需要学生具备知识的基础,难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 某溶液加入足量硝酸银溶液产生白色沉淀,证明其中一定存在Cl- | |
| B. | 某溶液加入足量稀盐酸无现象,再加入BaCl2产生白色沉淀,证明其中一定存在SO42- | |
| C. | 某溶液加人稀盐酸产生无色、无味能使澄请石灰水变混浊的气体,证明其中一定存在CO32- | |
| D. | 向品红溶液中通入某气体后,品红溶液红色消失,证明该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 偏铝酸钠溶液:K+、NO3-、NH3•H2O | |
| B. | 空气:C2H6、CO2、SO2、NO | |
| C. | 硫酸铜溶液:H+、K+、S2-、Br- | |
| D. | 重铬酸钾钾溶液:H+、Na+、SO42-、乙醛分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相等时密度之比为2:1 | |
| B. | 原子数相等时具有的电子数之比为1:4 | |
| C. | 质量相等时具有的质子数之比为4:5 | |
| D. | 体积相等时具有的原子数之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. )的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式
)的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法不正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法不正确的是( )| A. | 线段Ⅲ表示Br-的变化情况 | B. | 原溶液中n(FeI2):n(FeBr2)=1:3 | ||
| C. | 线段Ⅳ表示IO4-的变化情况 | D. | 根据图象可以计算a的值为6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com