
分析 发生3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,所以铜是还原剂、部分硝酸是氧化剂,还原剂发生氧化反应、氧化剂发生还原反应,以此来解答.
解答 解:该反应中Cu元素化合价由0价变为+2价,则Cu为还原剂,硝酸中部分N元素化合价由+5价变为+2价,硝酸为氧化剂,其得失电子最小公倍数是6,用双线桥标出该反应电子转移的方向和数目为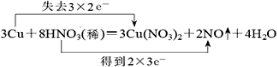 ,
,
故答案为: ;HNO3;Cu.
;HNO3;Cu.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
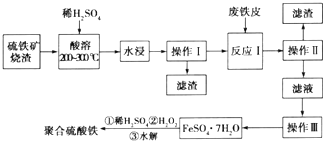
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ?乙烯使溴的四氯化碳溶液褪色 | |
| B. | ?乙烯通入酸性高锰酸钾溶液中 | |
| C. | ?在镍做催化剂的条件下,苯与氢气反应 | |
| D. | ?苯与液溴混合后撒入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
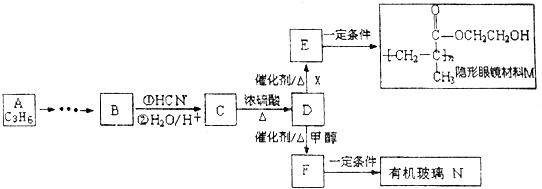
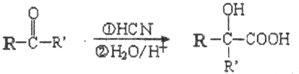 -R、-R′为可能相同或可能不同的原子或原子团
-R、-R′为可能相同或可能不同的原子或原子团 ,X中核磁共振氢谱峰面积比是2:1.
,X中核磁共振氢谱峰面积比是2:1. ,反应类型是加聚反应.
,反应类型是加聚反应.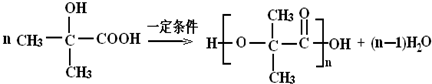 .
.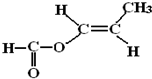 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片投入烧碱溶液Al+2OH-═AlO2-+H2↑ | |
| B. | 氯气与水反应Cl2+H2O?2H++Cl-+ClO- | |
| C. | 碳酸钙溶于盐酸CO32-+2H+═H2O+CO2↑ | |
| D. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
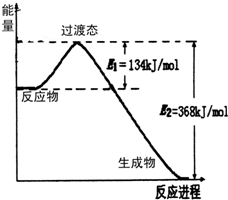 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
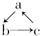 (“→”表示一步完成)关系相互转化的有( )
(“→”表示一步完成)关系相互转化的有( )| 物质 编号 | a | b | c |
| 1 | Na | Na2O2 | NaCl |
| 2 | NaOH | NaHCO3 | Na2CO3 |
| 3 | Al2O3 | NaAlO2 | Al(OH)3 |
| 4 | AlCl3 | Al(OH)3 | NaAlO2 |
| 5 | FeO | Fe(NO3)2 | Fe(OH)2 |
| 6 | MgCl2 | Mg(OH)2 | MgO |
| 7 | CuO | CuSO4 | Cu(OH)2 |
| 8 | Si | SiO2 | H2SiO3 |
| 9 | C | CO | CO2 |
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
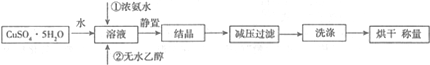

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com