
| A. | ①② | B. | ①③ | C. | ④ | D. | 均不正确 |
分析 ①H元素为非金属元素,最外层电子数为1;
②不少非金属元素在反应中能失去电子;
③碳原子数大于4的烃在常温下为液态或固态;
④非金属氧化物有酸性氧化物和不成盐氧化物.
解答 解:①H的最外层电子数为1,C和Si的最外层电子数为4,都不大于4,故①错误;
②非金属较弱的非金属元素在反应中能失去电子,可做还原剂,如H、C、S等,故②错误;
③碳原子数大于4的烃在常温下为液态或固态,氨气为气态,N2H4在常温下为液态,故③错误;
④CO、NO等氧化物为非金属性氧化物,但不具有酸性,为不成盐氧化物,故④错误.
故选D.
点评 本题考查非金属元素的性质,为高频考点,熟悉元素及其单质、化合物的性质即可解答,并注意利用特例来解答.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
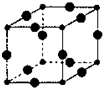 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.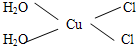 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性:H2SO4>HClO4>HBrO4 | B. | 碱性:RbOH>KOH>NaOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑦⑧ | B. | ①③④⑦⑨ | C. | ①⑤⑥⑧⑨ | D. | ①②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3(CH2)4CH3 1,4-二甲基丁烷 | |
| B. | CH3CH(CH3)CH=CH2 甲基丁烯 | |
| C. | CH3CH2CH(CH3) CH2OH 2-甲基-1-丁醇 | |
| D. | CH2ClCH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | CH≡CH和C6H6含碳量相同 | |
| C. | 乙炔和苯互为同系物 | |
| D. | 正戊烷、异戊烷、新戊烷的沸点逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com