
分析 (1)N3-离子原子核外共有10个电子,根据能量最低原理可写出电子排布式;
(2)O=O中含有1个π键,1个σ键,O-O中含有1个σ键,已知O=O键的键能为497.3kJ•mol-1,O-O键的键能为142kJ•mol-1,则1个π键的键能为497.3kJ•mol-1-142kJ•mol-1 =355.3kJ•mol-1 以此判断;
(3)根据BF3中B原子无孤电子对,存在空轨道,F-能提供孤电子对;
(4)根据X+中所有电子正好充满K、L、M三个电子层,故X元素原子核外电子数为2+8+18+1=29,为Cu元素;Cu为29号元素,根据构造原理书写其离子基态核外电子排布式;
(5)等电子体中原子数相同、价电子数相同;根据等电子体结构相似写出结构式,共价单键是σ键,共价双键中一个是σ键,一个是π键,共价三键中一个是σ键,两个是π键;
解答 解:(1)N原子原子序数为7,N3-离子原子核外共有10个电子,且最外层达到稳定结构,根据能量最低原理可写出电子排布式为1s22s22p6,
故答案为:1s22s22p6;
(2)O=O中含有1个π键,1个σ键,O-O中含有1个σ键,已知O=O键的键能为497.3kJ•mol-1,O-O键的键能为142kJ•mol-1,则1个π键的键能为497.3kJ•mol-1-142kJ•mol-1 =355.3kJ•mol-1 以此判断,则N2中的π键键能大于σ键键能,较稳定,
故答案为:π;
(3)BF3中B原子无孤电子对,存在空轨道,F-能提供孤电子对,BF3与F-形成BF4-离子时,二者形成的化学键为配位键;
故答案为:配位;
(4)X+中所有电子正好充满K、L、M三个电子层,故X元素原子核外电子数为2+8+18+1=29,为Cu元素,Cu为29号元素,其一价阳离子核外电子排布式为:1s22s22p63s23p63d10,
故答案为:Cu;1s22s22p63s23p63d10;
(5)N2含有2个原子14个电子,所以N2互为等电子体的一种分子和一种离子的化学式为:CO;CO的结构式为C≡O,分子中含有一个是σ键,两个是π键,所以该分子中σ键与π键的个数比为 1:2;
故答案为:CO;1:2
点评 本题考查较为全面,涉及电子排布式、化学键的类型、等电子体的判断,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2、Cl2、N2、酸雨 | B. | SO2、CO、NO2、烟尘 | C. | NH3、CO、NO2、雾 | D. | SO2、HCl、N2、粉尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若把H2S写成H3S,则违背了共价键的饱和性 | |
| B. | H3O+的存在说明共价键不应有饱和性 | |
| C. | 所有共价键都有方向性 | |
| D. | 两原子轨道发生重叠后,电子在两核间出现的概率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:F<Mg<K | B. | 稳定性:PH3>H2S>NH3 | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
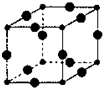 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性:H2SO4>HClO4>HBrO4 | B. | 碱性:RbOH>KOH>NaOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | CH≡CH和C6H6含碳量相同 | |
| C. | 乙炔和苯互为同系物 | |
| D. | 正戊烷、异戊烷、新戊烷的沸点逐渐降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com