
选用如图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓H2SO4氧化成CO2,下列说法正确的是( )
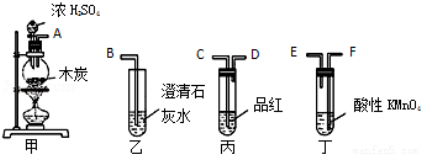
A. 按气流从左向右流向,连接装置的正确顺序是A→F→E→C→D→B
B. 丁中溶液褪色,乙中溶液变浑浊说明甲中生成CO2
C. 丙中品红溶液褪色,乙中溶液变浑浊说明甲中生成CO2
D. 丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高一上学期期末考试化学试卷(解析版) 题型:选择题
在反应Cl2+2NaOH =NaCl +NaClO+H2O的变化中,当产生58.5gNaCl时,转移电子总数是:( )
A. 1.204×1024个 B. 6.02×1023个 C. 4.816×1023个 D. 2.408×1023个
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:简答题
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g) CO(g)+H2O(g),平衡常数K与温度t℃的关系如下表:
CO(g)+H2O(g),平衡常数K与温度t℃的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为________________________。
②该反应为反应___________(填“吸热”或“放热”)。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度
为___________℃。
(2)工业上一般以CO和H2为原料合成甲醇,一定温度下在恒容容器中,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g)△H1=-116kJ·mol-1
CH3OH(g)△H1=-116kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________。
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1∶2
D.单位时间内,消耗2molH2的同时消耗1molCH3OH
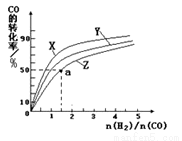
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是___________;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K等于___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
为了测定中和反应的反应热,计算时至少需要的数据是( )
①酸的浓度和体积 ②碱的浓度和体积 ③比热容④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
A. ①②③⑥ B. ①③④⑥ C. ③④⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:实验题
如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为:_____________.装置 B 中饱和食盐水的作用是_________________;
若C处发生了堵塞,则B中的现象为__________________.
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ应该依次放入____(填编号)
① | ② | ③ | ④ | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为______色,说明 ________________;打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是__________________;
(4)如果将二氧化锰与足量的浓盐酸混合加热,若有17.4g 的 MnO2 被还原,则被氧化的 HCl 的质量为_____.
(5)向 Na2CO3 溶液中通入氯气,可制得某种生产和生活中常用的漂白液,同时有 NaHCO3 生成,该反应的化学方程式是______.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:选择题
某温度下,将Cl2通入氢氧化钾溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A. 2:3 B. 4:3 C. 10:3 D. 11:3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 1mol FeI2与足量氯气反应时转移的电子数为2NA
B. 2L 0.5mol•L﹣1硫酸钾溶液中阴离子所带电荷数为NA
C. 1mol Na2O2固体中含离子总数为4NA
D. 22gCO2与标准状况下11.2LHCl所含的分子数相同
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式书写正确的是
A. 电解饱和氯化镁溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B. Fe(OH)3溶于氢碘酸:Fe(OH)3+ 3H+=Fe3++3H2O
C. NaAlO2溶液中 AlO2-的水【解析】
AlO2-+2H2O=Al(OH)3+ OH-
D. 向KAl(SO4)2溶液中加过量的Ba(OH)2溶液:Al3++2SO42- +2Ba2++4 OH-= AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期开学考试化学试卷(解析版) 题型:选择题
设NA 为阿伏加德罗常数的值,下列叙述正确的是
A. 22.4 L CO2与CO的混合气体中含碳原子数为NA
B. 常温下,1L 0.1 mol·L-1的NH4NO3溶液中氮原子数为0.2 NA
C. 在反应KIO3 + 6HI=KI + 3I2 + 3H2O中,每生成3 mol I2转移的电子数为6 NA
D. 在铁参与的反应中,5.6 g铁完全反应失去的电子数一定为0.3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com