

分析 (1)同一周期元素,ⅤA第一电离能大于ⅥA族;Fe原子3d、4s能级电子为其价电子;
(2)熔沸点较低的晶体为分子晶体;Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,为氧化铁,同时生成C的稳定氧化物二氧化碳;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式;该配体中Cu原子提供空轨道、N原子提供孤电子对;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键和δ键生成;
(5)利用均摊法计算晶胞中Fe原子个数;根据密度公式ρ=$\frac{m}{V}$计算.
解答 解:(1)N的电离能大于O,这三种元素第一电离能大小顺序是N>O>C;Fe原子3d、4s能级电子为其价电子,基态Fe原子的价电子排布式为3d64s2,
故答案为:N>O>C;3d64s2;
(2)熔沸点较低的晶体为分子晶体,Fe(CO)5又名羰基铁,常温下为黄色油状液体,其熔沸点较低,为分子晶体;Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,为氧化铁,同时生成C的稳定氧化物二氧化碳,
反应方程式为4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2,
故答案为:分子晶体;4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2,该配体中Cu原子提供空轨道、N原子提供孤电子对,
故答案为:sp3、sp2;N;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,
故选bd;
(5)利用均摊法计算晶胞中Fe原子个数,面心立方晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,所以二者Fe原子个数之比=4:2=2:1;
设Fe原子半径为rcm,面心立方晶胞半径=2$\sqrt{2}$rcm,其体积=(2$\sqrt{2}$rcm)3,
体心立方晶胞半径=$\frac{4\sqrt{3}}{3}$rcm,体积=($\frac{4\sqrt{3}}{3}$rcm)3,
其密度之比=$\frac{\frac{4M}{{N}_{A}}}{(2\sqrt{2}r)^{3}}$:$\frac{\frac{2M}{{N}_{A}}}{(\frac{4\sqrt{3}}{3})^{3}}$=4$\sqrt{2}$:3$\sqrt{3}$,
故答案为:2:1;4$\sqrt{2}$:3$\sqrt{3}$.
点评 本题考查晶胞计算,为高频考点,侧重考查学生分析计算及空间想象能力,涉及晶胞计算、原子杂化方式判断、元素周期律等知识点,难点是晶胞计算,注意Fe晶胞面心立方和体心立方区别,关键会正确计算两种晶胞体积,题目难度中等.


科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
通过以下反应均可获取H2。下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l) 2H2(g)+O2(g)ΔH1=571.6kJ/mol
2H2(g)+O2(g)ΔH1=571.6kJ/mol
②焦炭与水反应制氢:C(s)+H2O(g) CO(g)+H2(g)ΔH2=131.3kJ/mol
CO(g)+H2(g)ΔH2=131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g) CO(g)+3H2(g)ΔH3=206.1kJ/mol
CO(g)+3H2(g)ΔH3=206.1kJ/mol
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g) C(s)+2H2(g)的ΔH3=74.8kJ/mol
C(s)+2H2(g)的ΔH3=74.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min SO3/mg 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
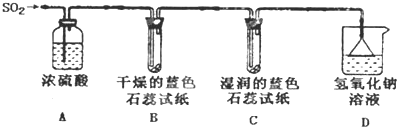
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
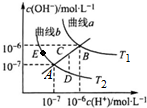
| A. | 图中温度T2>T1 | |
| B. | 曲线a、b均代表纯水的电离情况 | |
| C. | 图中五点的Kw的关系:B>C>A>D=E | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
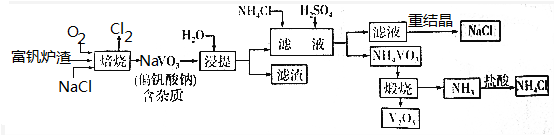
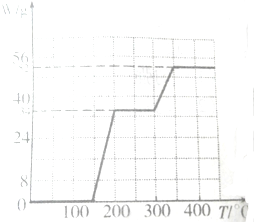
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的气态氢化物与其最高价氧化物的水化物之间能相互反应 | |
| B. | N单质能将K从其钠盐的水溶液中置换出来 | |
| C. | N的氢化物沸点高于其它同族元素氢化物的沸点 | |
| D. | P、Q、K对应的最高价氧化物的水化物相互之间可能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
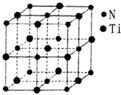 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题: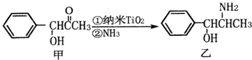
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com