实验室要配制0.5mol/L的NaOH溶液100mL,则:
(1)需要固体NaOH的质量为
2.0g
2.0g
;
(2)用托盘天平称量NaOH固体时,必须把NaOH放在
烧杯
烧杯
仪器中称量;
(3)配制时还需要用到的仪器有
ACFG
ACFG
(填字母)
A.烧杯 B.铁架台(带铁夹) C.100mL容量瓶 D.50mL容量瓶 E.蒸馏烧瓶 F.胶头滴管 G.玻璃棒
(4)按实验先后顺序排列下列实验步骤
①②③⑤⑥④⑧⑦
①②③⑤⑥④⑧⑦
(填编号)
①将称量好的NaOH固体倒入烧杯中;
②往烧杯中倒入约20mL蒸馏水;
③将溶解并冷却后的NaOH溶液移入容量瓶;
④向容量瓶中加蒸馏水到液面离瓶颈刻度线下1~2cm;
⑤用适量蒸馏水洗涤烧杯和玻璃棒2~3次;
⑥将洗涤后的溶液也注入容量瓶中;
⑦盖好瓶塞,反复上下颠倒、摇匀;
⑧用胶头滴管滴加蒸馏水至液面与瓶颈刻度线相切.
(5)以下因素会造成所配制的NaOH溶液物质的量浓度果偏低的是
C
C
A.NaOH溶液未经冷却后马上转移入容量瓶中
B.定容后发现液面低于刻度线补加蒸馏水
C.有少量NaOH溶液残留在烧杯中
D.容量瓶中原来有少量蒸馏水
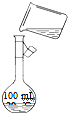
(6)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,右图是该同学转移溶液的示意图,其中的错误是
未用玻璃棒引流
未用玻璃棒引流
.

 实验室要配制0.5mol/L的NaOH溶液100mL,则:
实验室要配制0.5mol/L的NaOH溶液100mL,则:

