
(14分)有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示。其中B、C、D为单质,常温下D为固态,B、C、E、G为气态,F为淡黄色粉末,I的焰色反应为黄色。

请回答:
(1)写出F的电子式 ,其化学键类有 。
(2)写出反应⑤的化学方程式_____________________________________________。
(3)I的是溶液呈____性(填酸性、中性或碱性),原因(用离子反应方程式表示)_______________________ 。
![]() (4)B、C单质已被应用于字宙飞船的燃料电池中,如右图所示
(4)B、C单质已被应用于字宙飞船的燃料电池中,如右图所示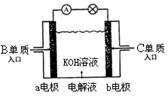 ,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电 极表面放电。b是电池的 极;a电极上的电极反应式是 。
,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电 极表面放电。b是电池的 极;a电极上的电极反应式是 。
(5)在①、②、③、④、⑤五个反应中,△H>0的反应是__________(填序号)。 (6)在标准状况下,若将11.2L气体G通入350mL 2mol/L的H溶液中,反应后溶液中离子浓度由大到小的顺序是 。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
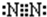
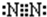
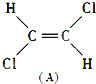 和
和 ,其中属于极性分子的结构式是
,其中属于极性分子的结构式是查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
请根据以上情况,回答下列问题:
(1)含有元素A的盐的焰色反应为 。许多金属盐都可以发生焰色反应,其原因是 。
(2)C的氢化物分子的键角是 ,属于 分子。(填“极性”或“非极性”)
(3)BD3的中心原子的杂化类型是
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5的晶体类型为 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为____ ___。
查看答案和解析>>
科目:高中化学 来源:2010年重庆一中高三下期第三次月考 题型:填空题
(14分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物。B、L、K 常温下为无色无味气体,I为有色有刺激性气味气体。G为黑色固体,F的焰色反应显紫色(透过钴玻璃观察)。反应⑤中,产物F、P的物质的量之比为1:1。各物质转化关系如下图:
回答下列问题:
(1)P的电子式是_________;I所含元素在元素周期表中的位置是________________;
(2)写出反应①的离子方程式: ______________________________________________;
(3)M的水溶液呈___________(填“酸性”“碱性”“中性”),用离子方程式说明原因:______________________________________________________________
(4)用惰性电极电解400.00mL A溶液,一段时间后测得溶液pH=1,此时需要向溶液中加入___________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年吉林省吉林一中高二下学期第一次月考化学试卷 题型:填空题
(14分)已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
请根据以上情况,回答下列问题:
(1)含有元素A的盐的焰色反应为 。许多金属盐都可以发生焰色反应,其原因是 。
(2)C的氢化物分子的键角是 ,属于 分子。(填“极性”或“非极性”)
(3)BD3的中心原子的杂化类型是
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5的晶体类型为 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为____ ___。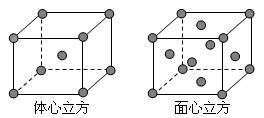
查看答案和解析>>
科目:高中化学 来源:2012届吉林省高二下学期第一次月考化学试卷 题型:填空题
(14分)已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
请根据以上情况,回答下列问题:
(1)含有元素A的盐的焰色反应为 。许多金属盐都可以发生焰色反应,其原因是 。
(2)C的氢化物分子的键角是 ,属于 分子。(填“极性”或“非极性”)
(3)BD3的中心原子的杂化类型是
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5的晶体类型为 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为____ ___。
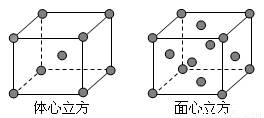
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com