
| PH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| pH值 | 6.5-8.5 |
| Ca2+,Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
PH | 6.5—8.5 |
Ca2+、Mg2+总浓度/mol·L-1 | <0.0045 |
细菌总数/个·mol | <100个 |
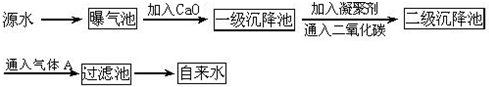
图3-14是原水处理成自来水的工艺流程示意图:
![]()
图3-14
(1)原水中含Ca2+、Mg2+、![]() 、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式__________________________________________________。
、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式__________________________________________________。
(2)凝聚剂除去悬浮固体颗粒的过程___________________________。(填写编号,多选倒扣)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,它在水中最终生成___________________________沉淀。
(3)通入二氧化碳的目的是__________________和____________________。
(4)气体A的作用是___________。这种作用是基于气体A和水反应的产物具有________性。
(5)下列物质中,______________可以作为气体A的代用品。(填写编号,多选倒扣)
①Ca(ClO)2 ②浓氨水 ③K2FeO4 ④SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
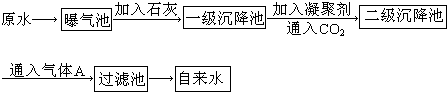
我国规定饮用水质量标准必须符合下列要求:pH为6.5—8.5,Ca2+和Mg2+总浓度小于0.004 5 mol·L-1,细菌总数小于100个每毫升。下图是源水处理成自来水的工艺流程示意图。

(1)源水中含Ca2+、Mg2+、![]() 、Cl-等,加入石灰后,生成Ca(OH)2,进而发生多个复分解反应,请写出其中三个反应的离子方程式:①__________________;②__________________;③_________________________________。
、Cl-等,加入石灰后,生成Ca(OH)2,进而发生多个复分解反应,请写出其中三个反应的离子方程式:①__________________;②__________________;③_________________________________。
(2)凝聚剂除去悬浮固体颗粒的过程是______________________ (填序号)。
A.只是物理过程 B.只是化学过程 C.是物理和化学过程
(3)绿矾在水中最终生成______________________沉淀。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省协作体高三5月第二次联考化学试卷(解析版) 题型:填空题
(1)下列关于工业生产说法正确的是 。(填序号)
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
|
pH |
Ca2+ 、Mg2+总浓度 |
细菌总数 |
|
6.5~8.5 |
< 0.004 5 mol·L-1? |
<100个·mL-1? |
以下是原水处理成自来水的工艺流程示意图:

①原水中含Ca2+ 、Mg2+ 、HCO3- 、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个): ; 。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 沉淀;通入二氧化碳的目的是 和 。
③气体A的作用是 ,下列物质中 可以作为气体A的代用品(填编号)。
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2 e.漂白粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com