
【题目】下列实验装置或操作设计正确、且能达到目的的是( )
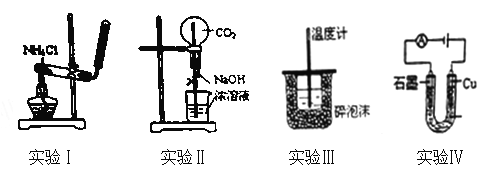
A. 实验Ⅰ:实验室制备氨气 B. 实验Ⅱ:用二氧化碳作喷泉实验
C. 实验Ⅲ:进行中和热的测定 D. 实验Ⅳ:电解氯化铜溶液得到铜和氯气
科目:高中化学 来源: 题型:
【题目】按如图所示的装置进行电解实验。A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量)。通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05 g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为
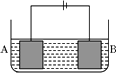
A.4∶1 B.3∶1 C.2∶1 D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是两根石墨棒。下列叙述正确的是
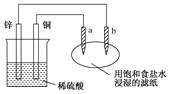
A. a是正极,发生还原反应
B. b是阳极,发生氧化反应
C. 稀硫酸中硫酸根离子的物质的量不变
D. 往滤纸上滴加酚酞试液,a极附近颜色变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体牛成,将气体通人澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( )
A.Cl-,S042-
B.Cl-,NO3-
C.Cl-,CO32-
D.Cl-,OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用胶体的有关知识解释的现象是( )
A.盐卤或石膏加入豆浆里制成豆腐
B.冶金厂利用高压直流电除去大量粉尘
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D.在河水与海水的交界处,易形成三角洲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,已知⑤为短周期元素,其单质为淡黄色固体,据表回答有关问题:
① | ② | ||||||
③ | ④ | ⑤ | ⑥ | ⑦ | |||
⑧ | ⑨ |
(1)画出元素⑧的原子结构示意图 __________________
(2)在这些元素中,最活泼的非金属元素是 ______, 最不活泼的元素是_____(写元素符号 )。
(3)在这些元素的最高价氧化物对应水化物中, 碱性最强的是 __________(写化学式),呈两性的氢氧化物是____________(写化学式),写出两者之间反应的离子方程式: ______________________________
(4)在⑥与⑨中,化学性质较活泼的是________(写元素符号 ),写出可以验证该结论的一个化学反应方式 _________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种短周期元素,原子序数依次增大。由A、B形成的单质在一定条件下可生成气体X且X的水溶液呈碱性;D原子K层电子数是其M层电子数的2倍;E的简单阳离子与X具有相同电子数,且E的简单阳离子是同周期中简单离子半径最小的元素;F元素的原子最外层比次外层少两个电子,C和G的最外层电子数之和为13 。则
(1)C在周期表中的位置为 _________________ ;
(2)写出:D在C单质中燃烧所生成淡黄色的固体的电子式_______________
(3)A、B、D、E四种元素的原子,半径由大到小的顺序为________________。(用元素符号表示 )
(4)G的单质在反应中常作氧化剂,该单质的水溶液与F的低价氧化物反应的化学方程式为______________________。
(5)写出由A、C、D、F这四种元素共同组成的2种化合物在水溶液中发生反应的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅元素的叙述中,正确的是( )
A.SiO2不溶于水,也不溶于任何酸
B.SiO2是良好的半导体材料
C.硅是地壳中含量最多的元素
D.水玻璃可用作木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列气体的制备和性质实验中,由现象得出的结论正确的是________
选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
B | 浓盐酸、浓硫酸 | 蓝色石蕊试纸 | 变红 | HCl为酸性气体 |
C | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
D | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
Ⅱ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3, NH4HCO3很容易分解。 2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00LNaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为__________________(填浓度范围)。
(3)CO2和 KO2 有下列反应:4KO2+2CO2=2K2CO3+3O2
4KO2+4CO2+2H2O=4K2HCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的物质的量应该是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com