
【题目】氨氮是水体中氮的主要形态之一,氨氮含量过高对水中生物会构成安全威胁。
(1)一定条件下,水中的氨氮可以转化为氮气而除去。
已知:2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH=a kJ·mol-1
2NO2-(aq)+O2(g)=2NO3-(aq) ΔH=b kJ·mol-1
5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH=c kJ·mol-1
则4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=________kJ·mol-1。
(2)实验室用电解法模拟处理氨氮废水。电解时,不同氯离子浓度对溶液中剩余氨氮浓度的影响如图所示。增大氯离子浓度可使氨氮去除率____(填“增大”、“减小”或“不变”),其原因是阳极生成强氧化性气体,则阳极电极反应为_______。

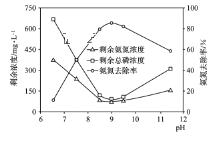
(3)化学沉淀法是一种处理高浓度氨氮废水的有效方法。通过加入MgCl2和Na2HPO4将NH4+转化为MgNH4PO4·6H2O沉淀除去。25 ℃时,在氨氮初始质量浓度400 mg·L-1、n(Mg)∶n(P)∶n(N)=1∶1∶1的条件下,溶液pH对氨氮去除率及剩余氨氮浓度和总磷浓度的影响如图所示。
①反应生成MgNH4PO4·6H2O沉淀的离子方程式为______________。
②该实验条件下,控制溶液的适宜pH范围为________;当pH>9时,溶液中总磷浓度随pH增大而增大的主要原因是_________(用离子方程式表示)。
【答案】![]() 增大 2Cl--2e-=Cl2↑ HPO42-+Mg2++NH4++6H2O=MgNH4PO4·6H2O↓+H+ 8.5<pH<9.5 MgNH4PO4+2OH-=Mg(OH)2+NH4++PO43-[或MgNH4PO4+3OH-=Mg(OH)2+NH3·H2O+PO43-]
增大 2Cl--2e-=Cl2↑ HPO42-+Mg2++NH4++6H2O=MgNH4PO4·6H2O↓+H+ 8.5<pH<9.5 MgNH4PO4+2OH-=Mg(OH)2+NH4++PO43-[或MgNH4PO4+3OH-=Mg(OH)2+NH3·H2O+PO43-]
【解析】
(1)根据盖斯定律计算反应的焓变;
(2)根据图象分析,Cl-浓度增大,氨氮去除率增大,电解池中Cl-转化为Cl2,Cl2能氧化NH4+达到去除的目的;
(3)①MgCl2、Na2HPO4和NH4+反应生成MgNH4PO46H2O沉淀,据此写出反应的方程式;
②根据图象分析,当控制pH在8.5~9.5范围内,氨氮去除率较高,pH范围在9~11时,溶液中总磷浓度随pH增大而增大,考虑溶液碱性增强,MgNH4PO4在碱性条件下转化为Mg(OH)2和PO43-,导致溶液中总磷浓度增大。
(1)已知:①2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH1=a kJ·mol-1
②2NO2-(aq)+O2(g)=2NO3-(aq) ΔH2=b kJ·mol-1
③5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH3=c kJ·mol-1
将![]() ,整理可得反应方程式为:4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=
,整理可得反应方程式为:4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=![]() kJ/mol;
kJ/mol;
(2)根据图象分析,Cl-浓度增大,氨氮去除率增大,电解池中Cl-转化为Cl2,Cl2能够将NH4+氧化为氮气(或NO3-)而除去,阳极的电极反应式为:2Cl--2e-=Cl2↑;
(3)①MgCl2、Na2HPO4和NH4+反应生成MgNH4PO46H2O沉淀,所以发生的反应为:HPO42-+Mg2++NH4++6H2O=MgNH4PO4·6H2O↓+H+;
②根据图象分析,当控制pH在8.5~9.5范围内,氨氮去除率较高,当pH范围在9~11时,溶液中总磷浓度随pH增大而增大,考虑溶液碱性增强,MgNH4PO4在碱性条件下转化为Mg(OH)2和PO43-,导致溶液中总磷浓度增大,发生的反应为:MgNH4PO4+2OH-=Mg(OH)2+NH4++PO43-[或MgNH4PO4+3OH-=Mg(OH)2+NH3·H2O+PO43-]。


科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol/LNa2CO3溶液中逐滴加入20mL0.1mol/L的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
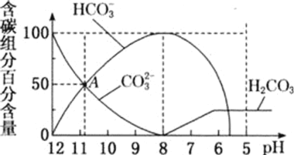
A.HCl溶液滴加一半即10mL时,溶液pH>7
B.0.1mol/LNa2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-)
C.在A点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.当pH=5时,溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:
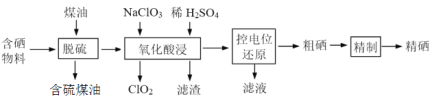
回答下列问题:
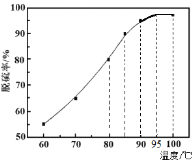
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。
(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。
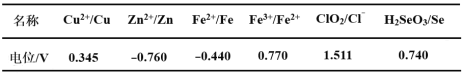
①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为___________,与粗硒中铁含量为0.89%相比,铁含量明显降低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42-)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为____。
A.在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中
B.在搅拌下,将KClO饱和溶液缓慢滴加到Fe(NO3)3饱和溶液中
C.在搅拌下,将KClO饱和溶液和Fe(NO3)3饱和溶液一起加入
反应的离子方程式为______________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>____。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.100 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.1000mol·L-1的AgNO3标准溶液分别滴加到20mL浓度均为0.1000mol·L-1的NaCl和NaBr溶液中,混合溶液的pAg [-lgc(Ag+)]与滴定百分数(滴定所用标准溶液体积相对于滴定终点时所用标准溶液体积的百分数)的变化关系如图所示。下列叙述错误的是
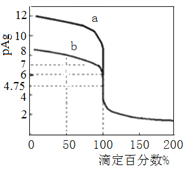
A. 曲线a代表滴定NaBr溶液
B. Ksp(AgCl) =1×10-9.5
C. 滴定至50%时,NaCl溶液中c(Na+) >c(NO3-)>c(Ag+)>c(H+)
D. 滴定至100%时,c(H+) +c(Ag+) = c(Br-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铜与过量浓硫酸反应的实验说法不正确的是( )

A.喷有碱液的棉花是为了防止 SO2 污染环境
B.将水注入反应后冷却的试管 a 中,溶液变为蓝色
C.SO2 能使 KMnO4 水溶液褪色
D.反应的化学方程式是 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机物。某化学兴趣小组对乙酸乙酯的制取进行探究活动。
[查阅资料]乙酸乙酯:无色、有芬芳气味的液体,沸点77℃,熔点-83.6℃,密度0.901g/cm3,溶于乙醇、氯仿、乙醚和苯等,微溶于水,在饱和碳酸钠中溶液溶解度更小,比水轻。
[反应原理]
CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
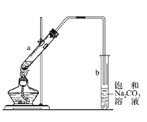
[实验探究]某化学兴趣小组设计如图装置进行实验。在大试管a内加入碎瓷片后,加入10mL乙醇,边振荡边加入5mL98%的浓H2SO4,冷却后再加入8mL冰醋酸,点燃酒精灯缓慢加热,将产生的蒸气经导管通入到试管b中的的饱和Na2CO3溶液的液面上,观察现象。
[问题讨论]
(1)试管a内加入碎瓷片的作用_______(填“防止暴沸”或“防止倒吸”);
(2)试管b中长导管没有伸入饱和Na2CO3溶液的原因是_______(填“防止暴沸”或“防止倒吸”);
(3)实验中饱和碳酸钠溶液的作用是_______________;
A.中和乙酸和乙醇
B.加速酯的生成,提高其产率
C.溶解乙醇,中和乙酸,降低乙酸乙酯的溶解,有利于分层析出。
(4)反应结束后试管b中的现象是_______;
A.溶液不分层
B.溶液分层,无色油状液体在上层
C.溶液分层,无色油状液体在下层
(5)若用9.2g乙醇与足量的冰醋酸反应,分离得到纯乙酸乙酯13.2g,反应的产率是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com