
“霾”是当今世界环境热点话题。目前各地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g)  2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)
2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)
在一定温度下,将2.0 molNO、2.4 mol CO气体通入固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如图所示:

① 0〜15 min NO的转化率为_________。
②20 min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将________(选填“向左”,“向右”或“不”)移动,重新达到平衡后,该反应的化学平衡数为_______________。
(2)己知: 2NO(g)+O2(g) =2NO2(g) △H=-bkJ·mol-1(b>0) ; CO的燃烧热 △H=-ckJ·mol-1(c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式________ 。
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为_____极,电解池中生成N2O5的电极反应式是__________________。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是

A. 反应达到平衡时,X的转化率为80%
B. 该反应的平衡常数表达式为K=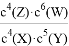
C. 增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:选择题
下列有关有机物结构、性质的分析正确的是
A. 乙醇、乙酸均能与 Na 反应放出 H2,二者分子中官能团相同
B. 乙烯和苯都能与 H2 发生加成反应,说明二者均含有碳碳双键
C. 苯可以在空气中燃烧,但不能被酸性高锰酸钾溶液氧化
D. 乙醇在铜催化作用下,能发生还原反应生成乙醛
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三下学期第一次联考理综化学试卷(解析版) 题型:实验题
氯化亚铜(CuCl)在有机合成工业中常作催化剂。它是一种白色固体,微溶于水,易被空气中的氧气氧化。某研究性学习小组先在HCl气流中微热分解CuCl2·2H2O制无水CuCl2,再加热制备CuCl,并用下图所示装置进行相关实验探究(夹持仪器略)。
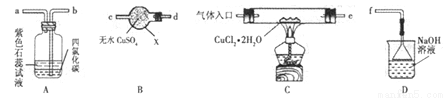
请回答下列问题:
(1)仪器X的名称是_________,装置连接顺序是 接_____、_____接_____、_____接f。
(2)实验操作的先后顺序是①→_____→_____→_____→⑤(填操作的编号)。
①检查装置的气密性后加入药品 ②熄灭酒精灯,冷却 ③在“气体入口”处通入干燥HCl
④点燃酒精灯,加热 ⑤停止通入HCl,然后通入N2其中通入N2气体的目的是________。
(3)在实验过程中,观察到B中物质由白色变为蓝色,A中上层溶液的颜色变化是______,下层CCl4的作用是①吸收少量Cl2;②________。
(4)装置D中发生的氧化还原反应的离子方程式为________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuO杂质,则产生的原因___________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三下学期第一次联考理综化学试卷(解析版) 题型:选择题
下列有关有机化合物的说法正确的是
A. 在铁催化作用下,苯与溴水能发生取代反应
B. 聚乙烯塑料中含有大量碳碳双键,容易老化
C. 有机物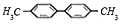 的一氯代物有5种
的一氯代物有5种
D. 乙酸乙酯、油脂分别与热Na0H溶液反应均有醇生成
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二下学期开学考试化学试卷(解析版) 题型:选择题
K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN的大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2==2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二下学期开学考试化学试卷(解析版) 题型:选择题
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是

A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阴离子向铁电极移动
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:填空题
(1)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为______。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为______
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为______
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备。某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3,则该小组同学实验时发生的总离子反应方程式为____。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高二上学期期末考试化学试卷(解析版) 题型:选择题
理论上不能设计为原电池的化学反应是( )
A. CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H<0
B. HNO3(aq)+NaOH(aq)==NaNO3(aq)+H2O(l) △H<0
C. 2H2(g)+O2(g)==2H2O(l) △H<0
D. 2FeCl3(aq)+Fe(s)==3FeCl3(aq) △H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com