
| 1������ | 2���� | 3���� | 4���� |
| 5����Ӧ��Ͷ���� | 6.1molCO��2molH2 | 7��l molCH3OH | 8.2molCO��4molH2 |
| 9��CH30H��Ũ�ȣ�mol/L�� | 10��cl | 11��c2 | 12��c3 |
| 13����Ӧ�������仯 | 14���ų�Q1kJ | 15������Q2kJ | 16���ų�Q3kJ |
| 17��ƽ�ⳣ�� | 18��Kl | 19��K2 | 20��K3 |
| 21����Ӧ��ת���� | 22��al | 23��a2 | 24��a3 |
| 1 |
| 1.6 |
| 1 |
| 1.6 |
| 18a |
| 64 |
| 82a |
| 64 |
| 82a |
| 64 |
| 98a |
| 64 |
| ||||
|



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
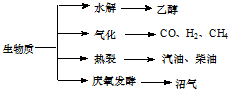 ��������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ������ͼ��
��������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ������ͼ��| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO��2molH2 | 1mol CH3OH | 2molCO��4molH2 |
| CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1 kJ | ����Q2 kJ | �ų�Q3 kJ |
| ƽ�ⳣ�� | K1 | K2 | K3 |
| ��Ӧ��ת���� | �� 1 | �� 2 | �� 3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| ��ѧ�� | C-C | C-H | H-H | S-H | S-S | S-C |
| ����/kJ��mol-1 | a | b | c | d | e | f |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������Ӧʽ | lgK | ||
| 700K | 900K | 1200K | |
| C��s��+H2O��g��=CO��g��+H2��g�� | -2.64 | -0.39 | 1.58 |
| C��s��+2H2O��g��=CO2��g��+2H2��g�� | -1.67 | -0.03 | 1.44 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ���㽭ʡ�����и����ڶ����ʼ죨���ۣ���ѧ���� ���ͣ������
(15��)��������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ��������ͼ��

��1�������й�˵����ȷ���� �� ��
a���������ܣ�������������Դ��̫����
b������ά��ˮ���õ��Ҵ���ȼ������������������
c���������ѽ��õ����͡����͵����ڴ�����
d����ֲ��ո˵��������ͻ�õ���������Ҫ�ɷ��Ǽ���
��2�����������ܻ�õ�CO��H2�����Ժϳɼ״��Ͷ����ѣ�CH3OCH3���������������ʡ�������1��1����Ӧ����ԭ�������ʴ�100%���ϳɵ����ʿ����� ��
a������ b���״� c����ȩ d������
��3���״���һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ϻϳɼ״��ķ�Ӧ��
CO(g)��2H2(g) CH3OH(g) ��H= -90.8kJ��mol-1��
CH3OH(g) ��H= -90.8kJ��mol-1��
�����¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
|
���� |
�� |
�� |
�� |
|
��Ӧ��Ͷ���� |
1molCO ��2molH2 |
1mol CH3OH |
2molCO��4molH2 |
|
CH3OH��Ũ�ȣ�mol/L�� |
c1 |
c2 |
c3 |
|
��Ӧ�������仯 |
�ų�Q1 kJ |
����Q2 kJ |
�ų�Q3 kJ |
|
ƽ�ⳣ�� |
K1 |
K2 |
K3 |
|
��Ӧ��ת���� |
�� 1 |
�� 2 |
�� 3 |
����˵����ȷ���� ��
a. c1 = c2 b. 2Q1 �� Q3 c. K1=K3 d. ��2+ ��3�� 100%
��4����һ���¶Ⱥ�ѹǿ�£�CO��H2���ϳɶ����ѵķ�ӦΪ��
3H2��g��+3CO��g��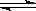 CH3OCH3��g��+CO2��g��
CH3OCH3��g��+CO2��g��
����һ����ɱ���ܱ������г���3 mol H2��3 mol CO��1 mol CH3OCH3��1 mol CO2����һ��ʱ��ﵽƽ�⣬�����ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6�����ٷ�Ӧ��ʼʱ�����淴Ӧ���ʵĴ�С��v(����____v(��)��� >������ < ����=������������
��ƽ��ʱn(CH3OCH3)= mol��
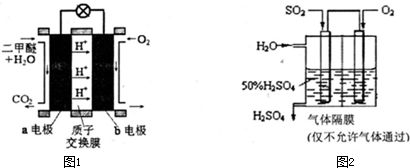
����ͼΪ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��
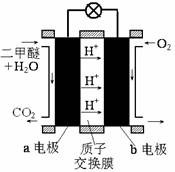
b�缫�� ����a�缫�ķ�ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com