
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为( )
A. 0.2mol B. 0.6mol C. 0.8mol D. 1.0mol
考点: 化学方程式的有关计算.
专题: 计算题.
分析: 51.2gCu的物质的量为0.8mol,整个过程发生的反应较复杂,但从氧化还原反应电子得失的角度分析可以简化为铜和氮间电子的转移,铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,我们可以认为铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),据此解答.
解答: 解:用终态分析法容易看出只有两种元素的价态有变化,其一是Cu→Cu(NO3)2,Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2,N元素由+5价降低为+3价,每个N原子得2个电子,51.2gCu的物质的量为:n(Cu)=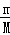 =
=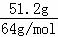 =0.8mol,共失电子为0.8mol×2=1.6mol,HNO3到NaNO2共得到电子1.6mol,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),故产物中NaNO2的物质的量为
=0.8mol,共失电子为0.8mol×2=1.6mol,HNO3到NaNO2共得到电子1.6mol,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),故产物中NaNO2的物质的量为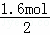 =0.8mol,
=0.8mol,
故选C.
点评: 本题考查氧化还原反应的有关计算,难度中等,用终态分析法判断失去的电子等于HNO3到NaNO2得到的电子是解题的关键.


科目:高中化学 来源: 题型:
下列实验操作中有错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.实验室制取蒸馏水的装置中,温度计水银球应位于蒸馏烧瓶的支管口处
C.用萃取的方法分离碘水
D.用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:乙醇可被强氧化剂氧化为乙酸.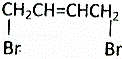 可经四步反应制取HOOCCH=CHCOOH.
可经四步反应制取HOOCCH=CHCOOH.
(1)第二步的反应类型是 :
(2)该制取过程中第二步的目的是: :
(3)写出第四步反应的化学方程式: :
查看答案和解析>>
科目:高中化学 来源: 题型:
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是 .
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的 形成配位键.
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 .
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为 (用元素符号作答).
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为 .
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 (填晶体类型).
查看答案和解析>>
科目:高中化学 来源: 题型:
用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
A.形成较多的白色沉淀 B.排除SO42-以外的其它阴离子及Ag+的干扰
C.形成的沉淀纯度更高 D.排除Ba2+以外的其它阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
两份铝屑,第一份与足量盐酸反应,第二份与足量NaOH溶液反应,产生的氢气的体积比为1:2(相同状况下),则第一份与第二份铝屑的质量比为( )
A.1:l B.1:2 C.1:3 D.2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com