
【题目】已知:① R-NO2![]() R-NH2;
R-NH2;
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯为原料制备某些化合物的转化关系图:

(1)A 转化为B 的化学方程式是____________________________;
(2)在“![]() ”的所有反应中属于取代反应的是______________(填字母),属于加成反应的是__________________(填字母);C 转化为D 的化学方程式是_________________;
”的所有反应中属于取代反应的是______________(填字母),属于加成反应的是__________________(填字母);C 转化为D 的化学方程式是_________________;
(3)B 中苯环上的一氯代物有_______________种同分异构体。
【答案】![]() +CH3Cl
+CH3Cl![]()
 +HCl ab c
+HCl ab c ![]() +H2SO4
+H2SO4 ![]()
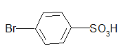 +H2O 4
+H2O 4
【解析】
苯与浓硝酸在浓硫酸作用下反应生成A,A为![]() ;根据已知信息,由
;根据已知信息,由 逆推可知B为
逆推可知B为 ;苯与溴在催化剂作用下反应生成C,C为
;苯与溴在催化剂作用下反应生成C,C为![]() ;由
;由![]() 逆推可知D为
逆推可知D为![]() ,据此分析解答。
,据此分析解答。
(1)A为![]() ,B为
,B为 ,A转化为B的化学方程式为
,A转化为B的化学方程式为![]() +CH3Cl
+CH3Cl![]()
 +HCl,故答案为:
+HCl,故答案为:![]() +CH3Cl
+CH3Cl![]()
 +HCl;
+HCl;
(2)a是苯与溴发生取代反应生成![]() ,b是
,b是![]() 与浓硫酸在加热条件下发生取代反应生成
与浓硫酸在加热条件下发生取代反应生成![]() ,c是
,c是![]() 与氢气发生加成反应生成
与氢气发生加成反应生成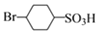 ,也属于还原反应;C 转化为D 的化学方程式为
,也属于还原反应;C 转化为D 的化学方程式为![]() +H2SO4
+H2SO4 ![]()
 +H2O,故答案为:ab;c;
+H2O,故答案为:ab;c;![]() +H2SO4
+H2SO4 ![]()
 +H2O;
+H2O;
(3)B( )中苯环上有4种化学环境不同的H原子,B中苯环上的一氯代物有4种同分异构体,故答案为:4。
)中苯环上有4种化学环境不同的H原子,B中苯环上的一氯代物有4种同分异构体,故答案为:4。


科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
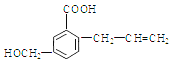
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。
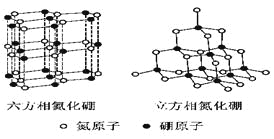
⑴基态硼原子的电子排布式为______________________________。
⑵ 关于这两种晶体的说法,正确的是_________________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
⑶六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是______________________________。
⑷立方相氮化硼晶体中,硼原子的杂化轨道类型为___________________。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是____________________________。
⑸NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有_____________mol配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如下图所示。此方法既能实现有效清除氮氧化物的排放,减轻环污染,又能充分利用化学能。下列说法正确的是( )

A.电流从左侧A电极经过负载后流向右侧B电极
B.电极B为正极,发生还原反应
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有4.48LNO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知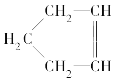 可简写为
可简写为![]() 。降冰片烯的分子结构可表示为
。降冰片烯的分子结构可表示为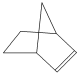 。
。
(1)降冰片烯属于________。
A.环烃 B.不饱和烃
C.烷烃 D.芳香烃
(2)下列对降冰片烯的性质的说法不正确的是________。
A.它可使酸性KMnO4溶液退色
B.它能使溴的四氯化碳溶液退色
C.它能溶于水
D.它燃烧时可发出明亮的火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的组合是( )
①组成金属的微粒是原子
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
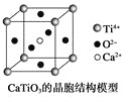
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A. ①②③⑥B. ①②④C. ③⑤⑦D. ③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。回答下列问题:

(1)写出Fe2+水解的离子方程式______;要抑制FeSO4水解,可以采取的措施是______。
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O24Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是______。
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响______。
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是______。
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200molL-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=______molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮元素是构成生物体的主要元素,在动植物生命活动中起着重要作用。根据要求回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在____________对自旋状态相反的电子。
(2)已知:(NH4)2CO3![]() 2NH3↑+H2O↑+CO2↑
2NH3↑+H2O↑+CO2↑
①与氧同周期,且第一电离能比氧大的元素有____________种。
②(NH4)2CO3分解所得的气态化合物分子的键角由小到大的顺序为____________(填化学式)。
(3)物质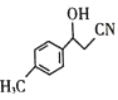 中C原子杂化方式是____________。
中C原子杂化方式是____________。
(4)配合物[Cu(CH3C![]() N)4]BF4中,铜原子的价电子布式为____________,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
N)4]BF4中,铜原子的价电子布式为____________,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
(5)碳元素与氮元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C原子的配位数为___________。该晶体硬度超过金刚石的原因是___________。
②已知该晶胞的边长为apm,阿伏加德罗常数用NA表示,则该晶体的密度为___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年中国水周的主题是:“节约保护水资源,大力建设生态文明”.
(1)ClO2和Cl2(还原产物都为Cl﹣)是生活中常用的净水消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_________倍.
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作流程和有关现象如图所示:操作③的相关图象如图
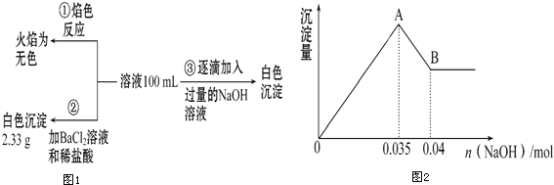
请根据上图回答下列问题:
①实验中需配制1.0molL﹣1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_______________.
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为___________.
③试确定NO3-是否存在?________(填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-)=_____(若不存在,此问不必作答).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com