
X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z)原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生下图所示变化,其中B和C均为10电子分子。下列说法不正确的是
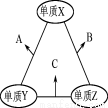
A.X元素位于ⅥA族
B.A不能溶于B中
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末化学试卷(解析版) 题型:选择题
已知氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列有关叙述中不正确的是()
①NH4H是离子化合物,含有离子键和共价键 ②NH4H溶于水所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂 ④NH4H固体投入少量的水中,有两种气体产生
A.①② B.②③ C.①②③ D.全部
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三高考前模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-丙基戊烷
B.已知C-C键可以绕键轴自由旋转,结构简式为 分子中至少有7个碳原子处于同一直线上
分子中至少有7个碳原子处于同一直线上
C.肌醇 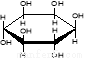 与葡萄糖
与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
D. 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4
与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市高三高考前最后一卷理综化学试卷(解析版) 题型:实验题
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料设计资源回收的工艺流程如下:
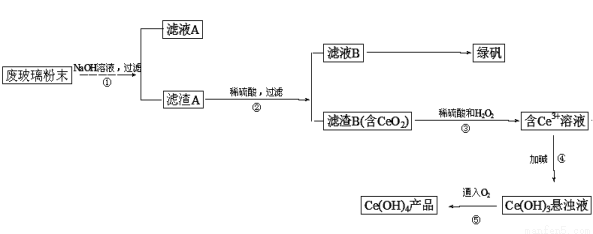 (1)写出第①步反应的离子方程式 。
(1)写出第①步反应的离子方程式 。
(2)洗涤滤渣B的目的是为了除去 (填离子符号),检验该离子是否洗净的方法是 。
(3)写出第③步反应的化学方程式_________________________。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得
到FeSO4溶液,再经 、 、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为80.00%)1.300g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为 mL。
(可能用到的相对原子质量 H=1 O=16 Ce =140 )
②该电解反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:填空题
海洋是一个巨大的物质资源和能量宝库,世界各国都在研究如何充分利用海洋资源。
Ⅰ. 从海水中可以提取食盐。
Ⅱ.从海水中提取镁。已知MgO、MgCl2的熔点分别为2800℃、604℃,从海水中提
取镁,最合理的方法是 。
A.海水 Mg(OH)2
Mg(OH)2 Mg
Mg
B.海水 MgCl2溶液→MgCl2熔融
MgCl2溶液→MgCl2熔融 Mg
Mg
C.海 水
水 Mg(OH)2
Mg(OH)2 MgO
MgO Mg
Mg
D.海水 Mg(OH)2
Mg(OH)2 MgCl2溶液→MgCl2熔融
MgCl2溶液→MgCl2熔融 Mg
Mg
Ⅲ.从海水中提溴。其工业方法有:空气吹出纯碱吸收法、空气吹出SO2吸收法、溶
剂萃取法等。
(1)空气吹出纯碱吸收法。将氯气通入富含溴离子的海水中,再用空气将溴吹出,
用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质.该方法涉及的反应有:
① (写出离子方程式);
②3Br2+3CO32﹣═BrO3﹣+5Br﹣+3C O2↑;
O2↑;
③BrO3﹣+5Br﹣+6H+═3Br2+3H2O
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,
然后再用氯气氧化即得单质溴。
写出溴与二氧化硫反应的化学 方程式: 。
方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:选择题
在一定条件下,反应N2+3H2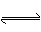 2NH3 在2 L密闭容器中进行,10 min时NH3的物质的量增加了0.2mol,则反应速率为
2NH3 在2 L密闭容器中进行,10 min时NH3的物质的量增加了0.2mol,则反应速率为
A.υ(H2)=0.02 mol / (L·min)
B.υ(N2)=0.02 mol / (L·min)
C.υ(NH3)=0.01 mol / (L·min)
D.υ(N2)=0.01 mol / (L·min)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:选择题
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g) +H2(g),反应过程中测定的部分数据见下表(表中t1 <t2),下列说法正确的是
CO2(g) +H2(g),反应过程中测定的部分数据见下表(表中t1 <t2),下列说法正确的是

A.反应在t1 min内的平均速率为v(H2)=0.40/t1moI/(L·min)
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2,到达平衡时,n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol CO,与原平衡相比,达到新平衡时CO转化率减小,H2O的体积分数也减小
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三下学期猜题理综化学试卷(解析版) 题型:填空题
纯碱是一种非常重要的化学基本工业产品,工业上有很多不同的方法生产纯碱。
Ⅰ、路布兰法——其生产原理:用硫酸将食盐转化为硫酸钠,将硫酸钠与木炭、石灰石一起加热,得到产品和硫化钙。
(1)请写出上述过程的化学方程式:____________。
Ⅱ.索尔维制碱法:以食盐、氨气(来自炼焦副产品)和二氧化碳(来自石灰石)为原料,首先得到小苏打,再加热分解小苏打,获得纯碱。
(2)结合下图中所给物质的溶解度曲线。写出得到小苏打的离子方程式:____________。
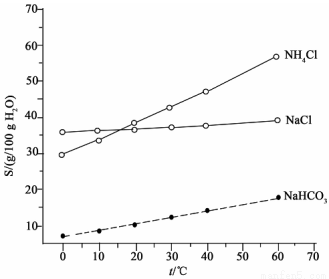
(3)这种生产方法的优点是原料便宜、产品纯度高、氨和部分二氧化碳可以循环使用。请写出实现氨循环的化学方程式:____________。
Ⅲ.侯德榜制碱法——生产流程可简要表示如下:
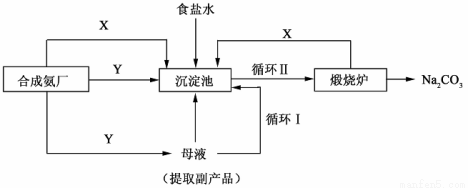
(4)合成氨工厂需要向制碱厂提供两种原料气体,其中Y是____________(填化学式),这两种气体在使用过程中是否需要考虑通入的先后顺序____________(填”是”或“否”),原因是____________。
(5)侯德榜制碱法保留了索尔维法的优点,克服了它的缺点,特别是设计了____________(填流程中的编号)使原料中溶质的利用率从70%提高到了96%以上。从母液中可以获得的副产品的应用:____________(举一例)。
(6)该合成氨厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其它损耗)的____________%(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com