
��.�������(K2FeO4)�Ǽ��õ������������и�Ч���������ã�Ϊһ�����ͷ��ȸ�Ч�������������������������£�

��ͬ���������⡣
��1��д����KOH��Һ��ͨ������Cl2������Ӧ�����ӷ���ʽ ��
��2������ҺI�м���KOH�����Ŀ���� (ѡ�����)��
A��Ϊ��һ����Ӧ�ṩ���ԵĻ���
B��ʹKClO3ת��ΪKClO
C������ҺI�й�����Cl2������Ӧ�����ɸ����KClO
D��KOH�����ܽ��ų��϶����������������߷�Ӧ���ʺ�KClO�Ĵ���
��3������Һ���з����K2FeO4�����и���ƷKNO3��KCl����Ӧ���з��������ӷ�Ӧ����ʽΪ ��Ҫ�Ƶ�69.3��K2FeO4�����������������������ʵ���Ϊ mol��
��4�����������һ�����Ͷ��ε�أ����ҺΪ����Һ���䷴ӦʽΪ��
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O��
3Zn+2K2FeO4+8H2O��
�ŵ�ʱ��صĸ�����ӦʽΪ ��
��.��(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬 �������ȼ�ϡ�
��5��д���·��ӵĵ���ʽ ��
��6��������N2O4��Ӧ��2N2H4(g)��N2O4(g)=3N2(g)��4H2O(g) ��H����1076.7 kJ/mol��
��֪��N2(g)��2O2(g)=N2O4(g)����H����8.7 kJ/mol�� д������O2��Ӧ����N2��H2O(g)���Ȼ�ѧ����ʽ ��
I.��1��2OH-+Cl2=ClO-+Cl-+H2O����2��AC��
��3��2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 0.525��
��4��Zn+2OH--2e-=Zn(OH)2 [�� Zn+2OH-=Zn(OH)2+2e- ��3Zn+6OH---6e-=3Zn(OH)2]
II����5��
��6��N2H4(g)��O2(g)=N2(g)��2H2O(g) ��H����534.0 kJ/mol
��������
�����������1��KOH��Cl2������ӦͬNaOH��Cl2������Ӧ����ΪKCl��KClO��
��2������ҺI�м���KOH����һ����Ϊ��һ����Ӧ�ṩ���ԵĻ�������һ��������ҺI�й�����Cl2������Ӧ�����ɸ����KClO����AC��ȷ��
��3����Ӧ�۴���Һ���з����K2FeO4�����и���ƷKNO3��KCl��˵��Fe3+����FeO42-��ClO-����Cl-����2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O����3KClO~2K2FeO4���Ƶ�69.3��K2FeO4������������n(KClO)Ϊ0.525mol��
��4���ŵ�ʱ���ý���Zn�ǵ�صĸ��������Ի�������ӦʽΪZn+2OH--2e-=Zn(OH)2��
��5��д�·��ӵĵ���ʽע��N-N��һ�Ե��ӹ��á�
��6������Ҫ��д����ѧ��ӦN2H4(g)��O2(g)=N2(g)��2H2O(g)���ɸ�˹���ɿ�֪����HΪ��֪������Ӧ�ĺ͵�һ�롣
���㣺�Ի�������Ϊ���壬����������ԭ��Ӧ����д���缫��Ӧʽ����д������ʽ���Ȼ�ѧ����ʽ����д�Ȼ�ѧ���


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 0.54g |
| 56+35.5x |
| 0.54g |
| 56+35.5x |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
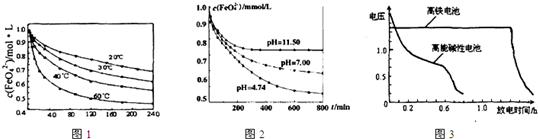
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(H+)��c(FeO42-) |
| c(HFeO4-) |
| c(H+)��c(FeO42-) |
| c(HFeO4-) |
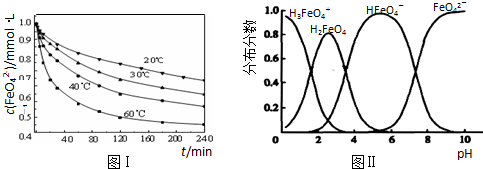
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com