
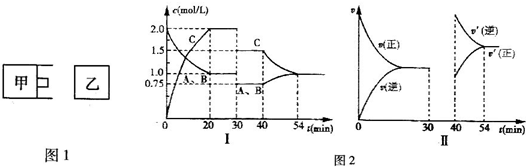
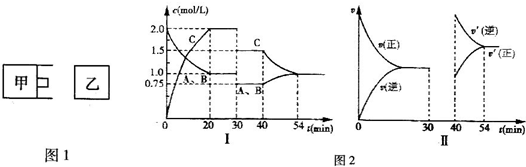
| 4 |
| 3 |
| 4 |
| 3 |
| △c |
| △t |
| 1mol/L |
| 20min |
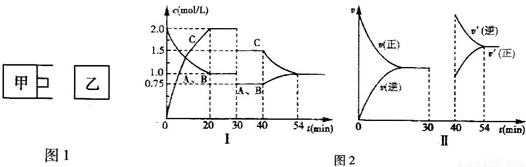
| 4 |
| 3 |
| 4 |
| 3 |
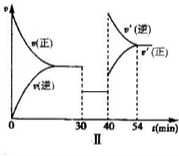 ,
, ;
;| 1 |
| 2 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2010-2011学年安徽省高三第一学期期中考试化学试卷 题型:选择题
在两个密闭容器中,分别充有质量相等的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的气体摩尔体积比乙的气体摩尔体积小
D.甲的相对分子质量比乙的相对分子质量少
查看答案和解析>>
科目:高中化学 来源:2010年湖北省高一上学期期中考试化学试卷 题型:选择题
在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是( )
A.若M(甲)<M(乙),则分子数:甲<乙
B.若M(甲)>M(乙),则气体摩尔体积:甲<乙
C.若M(甲)<M(乙),则气体的压强:甲>乙
D.若M(甲)>M(乙),则气体体积:甲<乙
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2013年高考化学备考复习卷B1:化学反应速率和化学平衡(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com