
Ⅰ 溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr = 2NaCl + Br2,该反应被氧化的元素为 ▲ (写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是 ▲ 个。
Ⅱ 请按要求书写化学方程式或离子方程式
(1)小明运用化学实验证明了久置于空气中的亚硫酸钠已变质,请用化学方程式表示亚硫酸钠变质的原因 ▲ 。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式 ▲ ;然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式 ▲ _。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)Ⅰ 溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr = 2NaCl + Br2,该反应被氧化的元素为 (写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是 个。
Ⅱ 请按要求书写化学方程式或离子方程式
(1)小明运用化学实验证明了久置于空气中的漂白粉已变质,请用化学方程式表示漂白粉变质的原因 。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式
;
然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式 _。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东济宁鱼台二中高一上学期期末模拟考试化学试卷 题型:填空题
(8分)Ⅰ 溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr =" 2NaCl" + Br2,该反应被氧化的元素为 (写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是 个。
Ⅱ 请按要求书写化学方程式或离子方程式
(1)小明运用化学实验证明了久置于空气中的漂白粉已变质,请用化学方程式表示漂白粉变质的原因 。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式
;
然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式 _。
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:实验题
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式 。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是 溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为 。
(4)可用如图实验装置精制粗溴。
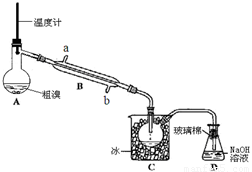
①图中冷却水应从B的 口进入(填“a”或“b”) 。
②C中加冰的目的是降温,减少溴的 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com