
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | ||||||||||
| B、向Cr2O72-+H2O?2CrO42-+2H+的平衡体系中滴加10~20滴6mol/LNaOH溶液颜色由橙色变黄色 | ||||||||||
C、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2(g)
| ||||||||||
D、已知:
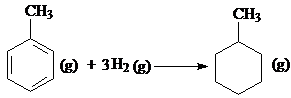 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag2S沉淀溶解平衡表达式:Ag2S?2Ag++S2- |
| B、硫代硫酸钠溶液和稀硫酸反应:SO42--+S2O32-+6H+=3SO2↑+3H2O |
| C、碳酸氢钠溶液与足量的氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、酸性高锰酸钾与草酸反应:MnO4-+H2C2O4+2H+=MnO2+2CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

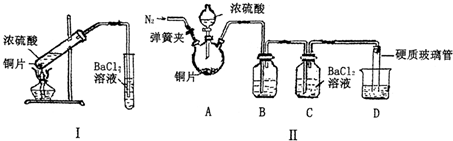
| 改进的操作或装置(注明必要的试剂) | 改进的作用 |
| 使用分液漏斗滴加浓硫酸 | 控制反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
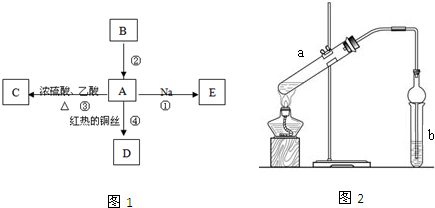
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取a克混合物充分加热,减重b克 |
| B、取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| C、取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
| D、取a 克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得 b 克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
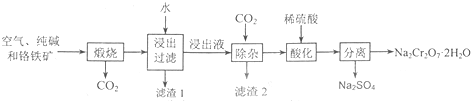
| ||
. |
| 绿矾 |
| H+ |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Q | I1 | I2 | I3 | I4 | I5… |
| 电离能 (Kj/mol) | 496 | 4562 | 6912 | 9543 | 13353 … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com