
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
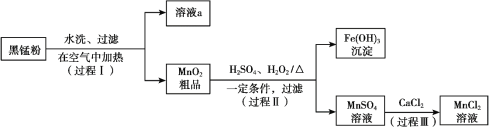
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
【答案】4MnO(OH)+O2==4MnO2+2H2O NH4++H2ONH3·H2O+H+(或NH4+水解产生H+) 蒸发浓缩,冷却结晶,过滤 加热NH4Cl粗品至340℃左右,NH4Cl = NH3 + HCl;收集产物并冷却,NH3 + HCl=NH4Cl,得到纯净NH4Cl。 KSCN溶液,不变红 MnO2+H2O2+H2SO4==MnSO4+2H2O+O2↑i中![]() 作催化剂,反应快,
作催化剂,反应快,![]() 只催化分解
只催化分解![]() ii中
ii中![]() 作氧化剂,加入稀
作氧化剂,加入稀![]() 后,
后,![]() 的氧化性增强,被
的氧化性增强,被![]() 还原为
还原为![]() 。
。
【解析】
(1)根据流程图可知,经过过程Ⅰ,得到了MnO2粗品,则O2将MnO(OH)氧化成MnO2,根据得失电子守恒,1molO2得到4mol电子,1molMnO(OH)失去1mol电子,则O2和MnO(OH)的比例为1∶4,再根据原子守恒可配平方程式,答案为4MnO(OH)+O2=4MnO2+2H2O;
(2)①ZnCl2和NH4Cl均为强酸弱碱盐,均会水解,铵根离子水解使溶液呈酸性,答案为NH4++H2ONH3·H2O+H+(或NH4+水解产生H+);
②从曲线可以看出,随着温度的变化,NH4Cl的溶解度几乎没有发生太大的变化,只能蒸发溶剂得到晶体,再进行后续操作,答案为蒸发浓缩,冷却结晶,过滤;
③从表格中数据可以知道,NH4Cl在337.8℃分解,生成NH3和HCl,而此温度下,ZnCl2没有熔化,也没有分解,因此可以利用NH4Cl的分解,收集产物再次合成NH4Cl,答案为加热NH4Cl粗品至340℃左右,NH4Cl = NH3 + HCl;收集产物并冷却,NH3 + HCl=NH4Cl,得到纯净NH4Cl;
(3)Fe3+的检验常用KSCN溶液,如果溶液中有铁离子,生成红色物质;没有Fe3+就不会变红,答案为KSCN溶液,不变红;
(4)从实验ⅰ知道,先加入双氧水,MnO2不溶解,只做催化剂,而通过实验ⅱ可知,先加入硫酸,固体溶解,且有气体冒出,气体为氧气,则MnO2作了氧化剂,双氧水作了还原剂。①固体溶解,且有气体放出,气体为O2,MnO2做氧化剂,H2O2做还原剂,为酸性环境,根据得失电子守恒和原子守恒,配平方程式。答案为MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O;
②先加入硫酸,溶液为酸性,则酸性条件下,物质的氧化性会增加,答案为ii中![]() 作氧化剂,加入稀
作氧化剂,加入稀![]() 后,
后,![]() 的氧化性增强,被
的氧化性增强,被![]() 还原为MnSO4。
还原为MnSO4。


科目:高中化学 来源: 题型:
【题目】
化合物F(异戊巴比妥)是临床常用的镇静催眠药物,其合成路线如下(部分反应条件和试剂略):
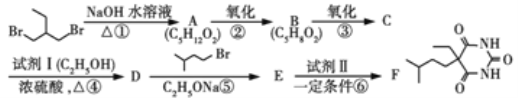
已知:
(1)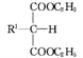 +R2Br+C2H5ONa
+R2Br+C2H5ONa![]()
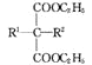 +C2H5OH+NaBr(R1,R2代表烷基)
+C2H5OH+NaBr(R1,R2代表烷基)
(2)R—COOC2H5+![]()
![]()
![]() (其他产物略)
(其他产物略)
请回答下列问题:
(1)试剂Ⅰ的化学名称是____,化合物B的官能团名称是______,第④步的化学反应类型是____。
(2)第①步反应的化学方程式是____________________。
(3)第⑤步反应的化学方程式是_____________________。
(4)试剂Ⅱ的相对分子质量为60,其结构简式是 ___________________。
(5)化合物B的一种同分异构体G与NaOH溶液共热反应,生成乙醇和化合物H。H在一定条件下发生聚合反应得到高吸水性树脂,该聚合物的结构简式是_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA
B. 1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
C. 将0.1 mol FeCl3溶于1 L水中,所得溶液含Fe3+离子数目为0.1NA
D. 在高温下,1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,不正确的是
A.在同温同压下,热化学方程式2H2(g)+O2(g)==2H2O(l)ΔH1;2H2(g)+O2(g)==2H2O(g)ΔH2,反应热ΔH1ΔH2
B.已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l)△H-57.3kJmol-1
BaSO4(s)+H2O(l)△H-57.3kJmol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,则:N2(g)+3H2(g)![]() 2NH3(g)△H-38.6kJmol-1
2NH3(g)△H-38.6kJmol-1
D.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)═CO(g)+2H2O(l)△H=-890.3kJmol-1
O2(g)═CO(g)+2H2O(l)△H=-890.3kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某碳酸钠溶液中逐滴加1 mol·L-1的盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2∶n1=3∶2,则下列说法中正确的是
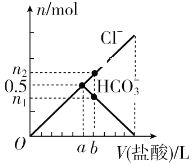
A. b点的数值为0.6
B. 该碳酸钠溶液中含有1 mol Na2CO3
C. b点时生成CO2的物质的量为0.3 mol
D. oa段反应的离子方程式与ab段反应的离子方程式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
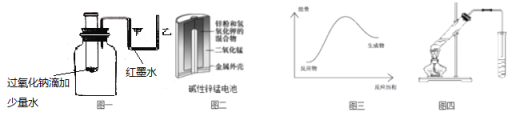
A.图一可表示模拟反应的能量变化,反应后左侧液面上升,右侧液面下降
B.图二所示电池中,MnO2的作用是催化剂
C.图三可表示需加热的放热反应
D.图四可用于乙酸和乙醇的酯化反应,小试管中是饱和碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C ![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 ![]() CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且未成对电子数最多的基态原子的电子排布式:___________;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O,由此可以推知CN22-的空间构型为________。
(2)1mol尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为_______;
(3)三聚氰胺俗称“蛋白精”,其结构为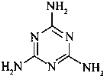 。其中氮原子的杂化方式有_____________。
。其中氮原子的杂化方式有_____________。
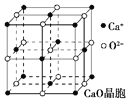
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______,Ca2+采取的堆积方式为____________,其中O2-处于Ca2+堆积形成的八面体空隙中;已知CaO晶体的密度为ρ,求晶胞中距离最近的两个钙离子之间的距离_____________(列出计算式);
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. pH=7的溶液:K+、Na+、Cl-、Fe3+
B. 能使酚酞显红色的溶液:Na+、Mg2+、HCO3-、SO42-
C. c(H+)/c(OH-)=1012的溶液:K+、Fe3+、Cl-、SO42-
D. 水电离出的c(H+)=10-13 mol·L-1的溶液:Ca2+、NH4+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g)![]() W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
A. B.
B.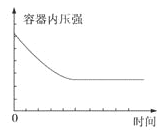
C.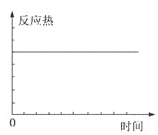 D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com