
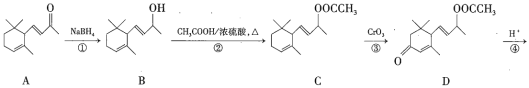
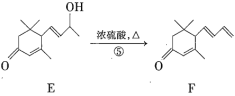
����Ŀ������ϩͪ(F)��һ����Ҫ�����ϣ���ϳ�·�����£�
��1��������F�ķ���ʽΪ_____________��1mol��������ȫȼ��������________molO2��
��2��������ת�������У���Ӧ����Ŀ����______________��д����Ӧ���Ļ�ѧ����ʽ��_______________��
��3������˵����ȷ����___________������ţ���
A.������A~F�����ڷ������������� B.��Ӧ�����ڻ�ԭ��Ӧ
C.1mol������D���Ը�4molH2������Ӧ D.������F�����������ŵ�����Ϊ̼̼˫�����ʻ�
��4����������������D��ͬ���칹�������֣�����һ��ͬ���칹��Ľṹ��ʽ����ͼ��ʾ����д����һ��ͬ���칹��Ľṹ��ʽ��__________________��

a.���ڷ��㻯���� b.�˴Ź���������ʾ����������4�ֲ�ͬ���͵���ԭ��
c. 1mol��������������2mol NaOH d.�ܷ���������Ӧ
���𰸡�C13H18O 17 �����ǻ�����ֹ�䱻CrO3����  +CH3COOH
+CH3COOH![]()
 +H2O BD
+H2O BD 
��������
�������еĺϳ�·�ߣ���֪����Ӧ��ΪA�������ԭ��Ӧ���������ʻ�(![]() )ת��Ϊ�ǻ��������л��ﴼ(B)���ڷ�Ӧ���иô���CH3COOH��Ũ���ᡢ���������·���������Ӧ������(C)������C��D�Ľṹ��ʽ�IJ�𣬿�֪��Ӧ��ΪC��CrO3��Ӧת��ΪD������C����������C=O����Ӧ������������������ˮ�����ɴ�(E)������Ũ������������·�����ȥ��Ӧ����ȥһ��H2O������̼̼˫�����ɾ���ϩͪ(F)����Ϻϳ�·����Ӧ�������з�����
)ת��Ϊ�ǻ��������л��ﴼ(B)���ڷ�Ӧ���иô���CH3COOH��Ũ���ᡢ���������·���������Ӧ������(C)������C��D�Ľṹ��ʽ�IJ�𣬿�֪��Ӧ��ΪC��CrO3��Ӧת��ΪD������C����������C=O����Ӧ������������������ˮ�����ɴ�(E)������Ũ������������·�����ȥ��Ӧ����ȥһ��H2O������̼̼˫�����ɾ���ϩͪ(F)����Ϻϳ�·����Ӧ�������з�����
��1�����ݺϳ�·����F�Ľṹ��ʽ��֪F�ķ���ʽΪC13H18O��1mol��������ȫȼ��������O2�����ʵ���=![]() ���ʴ�Ϊ��C13H18O��17��
���ʴ�Ϊ��C13H18O��17��
��2������ת��·�߿�֪���л���B�ڷ�Ӧ���Ĺ�������CH3COOH����������Ӧ��B�е��ǻ�ת��Ϊ�������ڷ�Ӧ������������ˮ����ת��Ϊ�ǻ����ɴ˿�֪��Ӧ����Ŀ���DZ����ǻ�����ֹ�䱻CrO3��������Ӧ���ķ�Ӧ����ʽΪ�� +CH3COOH
+CH3COOH![]()
 +H2O����Ϊ�������ǻ�����ֹ�䱻CrO3������
+H2O����Ϊ�������ǻ�����ֹ�䱻CrO3������ +CH3COOH
+CH3COOH![]()
 +H2O��
+H2O��
��3�����ݺϳ�·��
A��������A~F�ķ����о����������������ڷ������������A�����
B����Ӧ��Ϊͪ�ڻ�ԭ��������ת��Ϊ���ķ�Ӧ�����ڻ�ԭ��Ӧ��B����ȷ��
C��������D�����к���2��̼̼˫����1���ʻ�����1molD���Ը�3molH2�����ӳɷ�Ӧ��C�����
D������F�Ľṹ��ʽ��֪��F�еĹ�����Ϊ̼̼˫�����ʻ���D����ȷ��
��ѡBD��
��4��D����һ��ͬ���칹��Ҫ������������������˵����ͬ���칹�壺
a���������
b�������������ֵ�Ч�⣻
c�����ǻ��ܺ�NaOH��Ӧ����1mol���ǻ�����1molNaOH���ʸ�ͬ���칹�������Ӧ����2�����ǻ���
d��������Ҫ����ȩ����
����������������ͬ���칹��Ľṹ��ʽ����֪������ͬ���칹��Ľṹ��ʽ�е��ǻ����嶡������λ�ü��ɵõ�������������һ��ͬ���칹�塣�ʴ�Ϊ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ��ѧʵ�������߽����ã�����������������ɫ��ѧ������( )

��ʵ�����ռ���������ͼ����ʾװ��
��ʵ���������������Ʒ�Ӧ��ʵ��ʱ����ͼ����ʾװ��
��ʵ�������ò������ֱ�պȡŨ�����Ũ��ˮ����������������ε�ʵ��
��ʵ�����в���ͼ����ʾװ�ý���ͭ��ϡ����ķ�Ӧ
A.�ڢۢ�B.�٢ڢ�C.�٢ڢ�D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ԭ��Ӧ�ĵ���ת����Ŀ�ͷ���д��������
��1��2K2S + K2SO3 + 3H2SO4= 3K2SO4 + 3S��+ 3H2O _______������_______
��2��2KMnO4 ��5H2O2 + 3H2SO4 = K2SO4��2MnSO4��5O2�� �� 8H2O _______ ������_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ť����( Twistane)��һ�־��лӷ��ԵĻ���������ṹ�����ģ����ͼ��ʾ������˵����ȷ���ǣ� ��

A.����ʽΪC10H18
B.���ڶ��ұ���Ϊͬ���칹��
C.���ӽṹ�к���4����Ԫ��
D.���ȴ������3�֣����������칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��3�����ʽṹ������]����Ժ����ͨ���ġ�ȫ�������Դ�滮��2016����2020�꣩���У��״ν�өʯ��24�ֿ������ս���Կ��Ŀ¼��өʯΪ�����Ƶ�����������Ҫ��;����������ᡣ
��1����̬Fԭ�Ӻ�����ӹ���_____���˶�״̬����̬Ca2+�����������Ų�ͼΪ_____��
��2��ʵ�����Ʒ���������өʯ��Ũ���ᷴӦ�����÷�Ӧ�������ڲ��������н��У����û�ѧ��Ӧ����ʽ����ԭ��_____���÷�Ӧ�漰��Ԫ�ص縺��������_____����Ԫ�ط��ű�ʾ�����÷�Ӧ�IJ���֮һ���뷴Ӧ�������Ӧ����H2SiF6����H2SiF6���ӵ�����ԭ�Ӽ۲���Ӷ���Ϊ_____��
��3��CaF2��CaCl2�۵�Ƚϵ͵�������_____��ԭ����_______________��CaF2������ͼ������Ca2+����λ��Ϊ_____����CaF2������Ca2+�����Ӱ뾶Ϊa cm��F�������Ӱ뾶Ϊbcm����CaF2���ܶ�Ϊ_____gcm��3���谢���ӵ�������ֵΪNA����
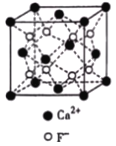
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t��ʱ����2molSO2��1molO2ͨ�����Ϊ2L�ĺ��º����ܱ������У��������·�Ӧ��2SO2(g)+O2(g)2SO3(g)����H=-196.6kJ/mol��2minʱ��Ӧ�ﵽ��ѧƽ�⣬��ʱ��÷�Ӧ��O2��ʣ��0.8mol������д���пհף�
(1)����������֤���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����(���ţ���ͬ)_________
A��������ѹǿ���ٷ����仯B��SO2������������ٷ����仯
C�������������������ٷ����仯D�������������ܶȲ��ٷ����仯
(2)�ӷ�Ӧ��ʼ���ﵽ��ѧƽ�⣬����SO3ƽ����Ӧ����Ϊ___________����Ӧ�ų�������Ϊ_____kJ��
(3)��Ӧ�ﵽ��ѧƽ������²���������ƽ��������Ӧ�����ƶ��������SO2ת���ʵ���______��
A����������ͨ������O2B����������ͨ������SO2C��ʹ�ô���D�������¶�E����������ͨ����������(��֪������SO2��O2��SO3����������Ӧ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�����Ϊm������A������Ϊn������B�ķ�������ͬ������˵���в���ȷ���ǣ� ��
A.����A������B����Է���������Ϊm��n
B.ͬ��������A������B�ķ��Ӹ�����Ϊn��m
C.ͬ��ͬѹ�£�A������B������ܶȱ�Ϊn��m
D.��ͬ״���£�ͬ�����A������B�����������Ϊm��n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ���������о�Ԫ�ؼ��仯��������ʾ�����Ҫ�����塣
I.���ֶ���������Ԫ�ص�����������Ӧ��ˮ����![]() Ũ�Ⱦ�Ϊ
Ũ�Ⱦ�Ϊ![]() ��Һ��pH��ԭ�������Ĺ�ϵ��ͼ��ʾ��
��Һ��pH��ԭ�������Ĺ�ϵ��ͼ��ʾ��

![]() Ԫ��R�����ڱ��е�λ����______��Ԫ��Z��ԭ�ӽṹʾ��ͼ��______��
Ԫ��R�����ڱ��е�λ����______��Ԫ��Z��ԭ�ӽṹʾ��ͼ��______��
![]() Ԫ��Y��W�γɵ�
Ԫ��Y��W�γɵ�![]() �ͻ������к��л�ѧ��������Ϊ______��
�ͻ������к��л�ѧ��������Ϊ______��
![]() ������Ԫ��C��O��S���γɶ��ֻ������
������Ԫ��C��O��S���γɶ��ֻ������![]() ��
��![]() ��COS�ȡ�
��COS�ȡ�
![]() ������˵��̼��������Ԫ�طǽ��������ǿ������______
������˵��̼��������Ԫ�طǽ��������ǿ������______![]() �����
�����![]()
A.S��![]() �������Ϸ�Ӧ��C��
�������Ϸ�Ӧ��C��![]() ���ϸ�����
���ϸ�����
B.���ԣ�![]()
C.![]() ��̼Ԫ��Ϊ
��̼Ԫ��Ϊ![]() �ۣ���Ԫ��Ϊ
�ۣ���Ԫ��Ϊ![]() ��
��
![]() Ǧ
Ǧ![]() ����
����![]() ����
����![]() ��Ԫ��Cͬ���塣�������䵥���ڿ����У��������Ӧ����Ǧ���������һ������Ǧ�����������Ӧ�����������ᷴӦ���ɴ˿ɵó����½��ۣ�
��Ԫ��Cͬ���塣�������䵥���ڿ����У��������Ӧ����Ǧ���������һ������Ǧ�����������Ӧ�����������ᷴӦ���ɴ˿ɵó����½��ۣ�
![]() ���ԭ������Ϊ______��
���ԭ������Ϊ______��
![]() ����
����![]() ����������ļ�����ǿ����˳��Ϊ______
����������ļ�����ǿ����˳��Ϊ______![]() �ѧʽ
�ѧʽ![]() ��
��
![]() �ʻ���
�ʻ���![]() ����Ϊһ��Ѭ�������ܷ�ֹijЩ���桢�߳��Σ��������ӽṹ��
����Ϊһ��Ѭ�������ܷ�ֹijЩ���桢�߳��Σ��������ӽṹ��![]() ���ơ�
���ơ�
![]() �õ���ʽ��ʾ�ʻ���
�õ���ʽ��ʾ�ʻ���![]() ���γɹ��̣�______��
���γɹ��̣�______��
![]() �ʻ���
�ʻ���![]() ������������Һ���������õĹ�����ͼ��
������������Һ���������õĹ�����ͼ��

��֪A��һ�����Σ���A�Ļ�ѧʽΪ______��������aΪ���ʣ���ӦII�����ӷ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L��1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L��1 | 0.05 | 0.05 | 0.1 |
����˵���������
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50%
B. ��Ӧ�ɱ�ʾΪX��3Y![]() 2Z
2Z
C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������
D. �����¶�ƽ�ⳣ��������˷�ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com