
��14�֣���֪A��B��C����ѧ��ѧ�ij������ʣ�������һ��������������ת����ϵ��
��1����A��ʹʪ��ĺ�ɫʯ����ֽ������CΪ����ɫ���塣��Aת��ΪB��Ӧ�Ļ�ѧ����ʽΪ������������������������������
��2����D�Ǿ��������Եĵ��ʣ�A���ڶ���������������ʣ���C���������Ӹ�����Ϊ ------ ��
��3����D�dz������ɽ�����������ӦB+D��C��Ƴ�ԭ��أ��������Ͽ��Բ���------ ��
�����ĵ缫��ӦʽΪ ������������ ��
��4����D��һ�ֳ������������壺A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӡ���Bת��ΪC�����ӷ���ʽΪ������ ��
��5����DΪ�ȼҵ����Ҫ��Ʒ��B�������ԣ���C��Һ�г�����������ڵ������ӵĻ�ѧʽΪ �������� ��
��6����A��B��C��Ϊ�����D��һ�ֺ�ɫ��̬�ǽ������ʣ���B���ӵĽṹʽΪ������ ��
��7����A��B��C����ʹʪ���pH��ֽ��죬����ͬ��������ɫ���μ����дһ����ҵ�ϲ��ð�ˮ����Bʱ��ˮ��Һ�з�����������ԭ��Ӧ�ķ���ʽ ��-��
��1�� 4NH3+5O2 4NO+6H2O (2)1:2 (3) ʯī��
Fe3++e��=Fe2+
4NO+6H2O (2)1:2 (3) ʯī��
Fe3++e��=Fe2+
��4��CO32-+CO2+H2O=2HCO3-
��5��AlO2- (6)O=C=O
(7)2NH4HSO3+O2=2NH4HSO4�ȡ���������1����A��ʹʪ��ĺ�ɫʯ����ֽ��������A�ǰ�����CΪ����ɫ���壬��C��NO2������D��������B��NO�����Aת��ΪB��Ӧ�Ļ�ѧ����ʽΪ4NH3+5O2 4NO+6H2O��
4NO+6H2O��
��2����D�Ǿ��������Եĵ��ʣ�A���ڶ���������������ʣ���A���ƣ�D��������B�������ƣ�C�ǹ������ƣ�����C���������Ӹ�����Ϊ1�U2��
��3����D�dz������ɽ�������D������B�к��������ӣ�C�к����������ӡ����Է�ӦB+D��C��Ƴ�ԭ��أ��������Ͽ��Բ���ʯī�ȡ�ԭ����������õ����ӣ���˵缫��Ӧʽ��Fe3++e��=Fe2+��
��4����D��һ�ֳ������������壬��D��CO2��A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�����A���������ƣ�B��̼���ƣ�C��̼�����ơ����Bת��ΪC�����ӷ���ʽΪCO32-+CO2+H2O=2HCO3- ��
��5����5����DΪ�ȼҵ����Ҫ��Ʒ��B�������ԣ���A�����Σ�B������������D���������ƣ�C��ƫ�����ơ�����C��Һ�г�����������ڵ������ӵĻ�ѧʽΪAlO2-��
��6����A��B��C��Ϊ�����D��һ�ֺ�ɫ��̬�ǽ������ʣ���A�ǽ��������B��CO2��D��̼��C��CO��CO2�Ǻ��м��Լ��Ĺ��ۻ�����ṹʽ��O=C=O��
��7����A��B��C����ʹʪ���pH��ֽ��죬����ͬ��������ɫ���μ��˵����Ӧ������������ǿ������A�����⣬B��SO2��C����������D�������������������μ��ױ��������������Σ����Է�Ӧ�ķ���ʽ������2NH4HSO3+O2=2NH4HSO4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X |
| X |


| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X |
| X |
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| �� |
| ||
| �� |
| Cu |
| �� |
| Cu |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
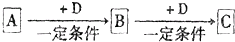 ��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ������������ͼ��ʾת����ϵ��
��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ������������ͼ��ʾת����ϵ��
| ||
| ||
| ||
| �� |
| ||
| �� |
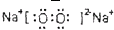
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
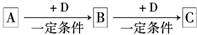
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com