
(共18分) W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。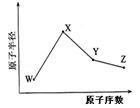
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是是同周期中非金属性最强的元素。
(1)X位于元素周期表的位置 ,X与硫元素形成的化合物的电子式为
(2) Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。理由为 。
(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中有存在的作用力有
其分子属于 (填极性分子、非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是 。
(4)在25ºC、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程是 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
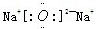
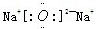


查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时,2p 轨道处于半充满状态 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
| Z | Z 的一种核素的质量数为65,中子数为 36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(共18分) W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是是同周期中非金属性最强的元素。
(1)X位于元素周期表的位置 ,X与硫元素形成的化合物的电子式为
(2) Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。理由为 。
(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中有存在的作用力有
其分子属于 (填极性分子、非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是 。
(4)在25ºC、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省高三九月诊断考试理综试卷(化学部分) 题型:填空题
(共18分) W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。
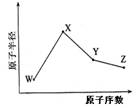
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是是同周期中非金属性最强的元素。
(1)X位于元素周期表的位置 ,X与硫元素形成的化合物的电子式为
(2) Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。理由为 。
(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中有存在的作用力有
其分子属于 (填极性分子、非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是 。
(4)在25ºC、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com