
| A、甲基橙 | B、pH计 | C、石蕊试纸 | D、pH试纸 |
科目:高中化学 来源:广东省惠州一中、深圳高级中学2011-2012学年高一下学期期末联考化学试题 题型:022
(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________.

(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的?H表示生成1 mol产物的数据).根据上图回答下列问题:
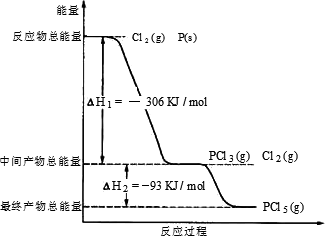
①P和Cl2反应生成PCl3的热化学方程式________;
②PCl5分解成PCl3和Cl2的热化学方程式是________;
(3)科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇(CH3OH)为燃料的燃料电池.已知:
CO(g)+1/2O2(g)=CO2(g); ΔH=-283.0 kJ·mol-1;
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1.
请回答下列问题:
液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为________
(4)已知稀溶液中,H2SO4与1 mol NaOH溶液恰好完全反应时,放出57.3 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式________.
(5)25℃、101 kPa条件下充分燃烧一定量的甲烷气体生成CO2气体和液态水,放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出甲烷燃烧的热化学方程式________.
(6)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
![]()
写出常温常压下氢气与氯气反应的热化学方程式________;
该反应中氢气与氯气的总能量________(填“大于”、“等于”、“小于”)氯化氢的总能量.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市直属六校高三第二次联考(2月)理综化学试卷(解析版) 题型:填空题
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)? ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g)? ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH=?????????????????????? .
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为???????????????????? 。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为:????????????????????????
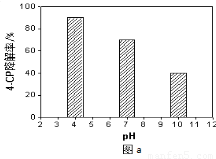 ???????????
??????????? 
(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强,???????????????? (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。
B.Fe2+是4-CP降解反应的催化剂
C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。
D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。
③当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解的平均反应速率的计算表达式为??????????????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08上海12校第二次联考)下列各项实验操作中错误的是 ( )
A.为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体
B.湿润的pH试纸可用于常见气体水溶液碱性的测定,不能用于未知溶液的pH测定
C.为了使配制的FeC13溶液不产生浑浊,可加入盐酸和铁片
D.实验室制备乙酸乙酯,硝基苯、酚醛树脂等均要水浴加热
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年温州市十二校月考)下图所涉及的物质均为中学化学中常见的物质,其中C、D、E为单质,其余为化合物,其中纳米F晶体材料可作为核磁共振造影增强剂,可用于疾病的诊断和药物载体,它们之间存在如下转化关系(部分产物已省略)。

请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式)____________;若反应①是在常温条件下进行的,则A是(填化学式)_____________;若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为_____________。
(2)H用途广泛如用作催化剂,印刷电路腐蚀剂和外伤止血剂及净水等。若将Cu棒与C棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为:
___________________ ______。总离子方程式为:__________ _______________。
F与B反应的离子方程式为:________ 。
(3)如经测定A为二元弱酸,其酸性比碳酸弱,写出A在水溶液中的电离方程式:______________________________________________________________________________。
A与氨气反应生成的酸式盐的化学式为:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08浙江温州十二校月考)下图所涉及的物质均为中学化学中常见的物质,其中C、D、E为单质,其余为化合物,其中纳米F晶体材料可作为核磁共振造影增强剂,可用于疾病的诊断和药物载体,它们之间存在如下转化关系(部分产物已省略)

请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式)____________;若反应①是在常温条件下进行的,则A是(填化学式)_____________;若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为_____________。
(2)H用途广泛如用作催化剂,印刷电路腐蚀剂和外伤止血剂及净水等。若将Cu棒与C棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为:_________。总离子方程式为:_______。
F与B反应的离子方程式为:___________。
(3)如经测定A为二元弱酸,其酸性比碳酸弱,写出A在水溶液中的电离方程式:___。
A与氨气反应生成的酸式盐的化学式为:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com