
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:物理教研室 题型:022
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
电负性 |
1.61 |
2.04 |
1.57 |
2.55 |
3.16 |
3.98 |
0.98 |
|
元 素 |
Mg |
N |
Na |
O |
P |
S |
Si |
|
电负性 |
1.31 |
3.04 |
0.93 |
3.44 |
2.19 |
2.58 |
1.90 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性的变化规律是:_______________________________________________________________________________。
(2)预测Br与Ⅰ元素电负性的大小关系________________,电负性最小的元素在周期表中的位置是:___________________________________(放射性元素除外)。
(3)习惯上把SrI2作为离子化合物,把BaS作为共价化合物。(电负性Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用DX表示,请找出用DX来判断离子键或共价键的数值范围:即当DX________时一般为离子键,当DX________时一般为共价键。试判断AlBr3中化学键的类型是________。
查看答案和解析>>
科目:高中化学 来源:设计必修一化学鲁科版 鲁科版 题型:022
溴和海水提溴
1.溴的存在
地球上99%的溴元素以Br-的形式存在于海水中.溴被称为________.溴是海水中的常量元素.
2.卤族元素
F、Cl、Br、I等原子结构和元素性质有一定的相似性,通称为卤族元素.
3.溴单质和碘单质的物理性质
实验1:

实验2:碘受热不经液体直接变成了固体——升华.
由于液态溴容易挥发成溴蒸气,因此,常常在盛溴的试剂瓶里加一些水来防止溴挥发,贮于阴凉处密闭保存.
由于碘易升华,所以必须将碘置于阴凉处,密闭保存.
碘易升华的性质,常用于碘的制取和从混合物中的分离,提取指纹等.
4.氯、溴、碘单质氧化性的强弱
实验方案和实验记录:
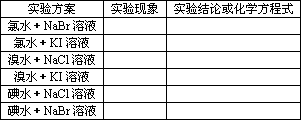
归纳整理1:氧化性:Cl2>Br2>I2(>S)
归纳整理2:Cl2可从溴化物的溶液里把Br2置换出来:
2Br-+Cl2![]() Br2+2Cl-
Br2+2Cl-
5.海水提溴的工艺流程

查看答案和解析>>
科目:高中化学 来源: 题型:022
已知元素的电负性和原子半径等内容一样,也是元素的一种基本性质,下面给出14种元素的电负性:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
电负性 |
1.61 |
2.04 |
1.57 |
2.55 |
3.16 |
3.98 |
0.98 |
|
元 素 |
Mg |
N |
Na |
O |
P |
S |
Si |
|
电负性 |
1.31 |
3.04 |
0.93 |
3.44 |
2.19 |
2.58 |
1.90 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性的变化规律是:_______________________________________________________________________________。
(2)预测Br与Ⅰ元素电负性的大小关系________________,电负性最小的元素在周期表中的位置是:___________________________________(放射性元素除外)。
(3)习惯上把SrI2作为离子化合物,把BaS作为共价化合物。(电负性Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用DX表示,请找出用DX来判断离子键或共价键的数值范围:即当DX________时一般为离子键,当DX________时一般为共价键。试判断AlBr3中化学键的类型是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com