
【题目】已知某温度下:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
2NH3(g)△H=-92.4kJ/mol,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
A.A中放热92.4kJ
B.B中放热46.2kJ
C.A中热量变化值大于B中2倍
D.A中热量变化值等于B中的2倍
科目:高中化学 来源: 题型:
【题目】KI用于分析试剂、感光材料制药和食品添加剂等。
制备原理如下:反应① 3I2+6 KOH =a KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O
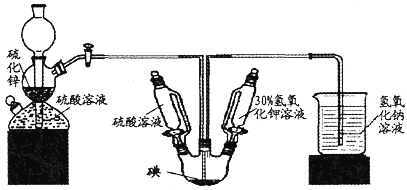
按照下列实验过程,请回答有关问题。
(1)启普发生器中发生的化学方程式为______________________,用该装置还可以制备___________(填一种气体化学式)。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到______________________(填现象),停止滴人KOH溶液;然后______________________(填操作),待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液,并对KI混合液水浴加热,其目的是______________________。
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和___________,其中加入碳酸钡的作用是______________________。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子
B. ClO3—的空间构型为平面三角形
C. SF6中有6对相同的成键电子对
D. SiF4和SO32—的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关117号元素Ts(中文名“![]() ”,tiǎn)的说法不正确的是( )
”,tiǎn)的说法不正确的是( )
A.基态Ts原子的电子所在最高电子层的符号是Q
B.基态Ts原子有一个未成对电子
C.Ts的电负性在同周期主族元素中最大
D.基态Ts原子有7种能量不同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ΔH=-akJ/mol
ΔH=-akJ/mol
下列说法中正确的是( )
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯分子比反-2-丁烯分子能量低
C.高温有利于生成顺-2-丁烯
D.等物质的量的顺-2-丁烯和反-2-丁烯分别与足量氢气反应,放出的热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a> c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)由CO2转化为羧酸是CO2资源化利用的重要方法。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。

①在合成CH3COOH的反应历程中,下列有关说法正确的是_____。(填字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为_____。
II.电解法转化CO2制HCOOH的原理如图。

①写出阴极CO2还原为HCOO-的电极反应式:_____。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____。
(2)由CO2合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2和H2可发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_____。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比![]()
②研究温度对于甲醇产率的影响。在210℃~290℃保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如图所示。ΔH____0(填“>”或“<”),其依据是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用废铁屑(含少量S等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4 ·6H2O](M=392g/mol),设计如图所示装置(夹持仪器略去)。
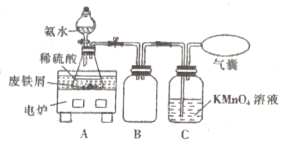
称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50 ~60°C热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)在实验中选择50~60℃热水浴的原因是___________________。
(2)装置B的作用是_______________________________。
(3)检验制得的(NH4)2SO4·FeSO4·6H2O中是否含有Fe3+的方法:将硫酸亚铁铵晶体用加热煮沸过的蒸馏水溶解,然后滴加________________(填化学式)。
(4)产品中杂质Fe3+的定量
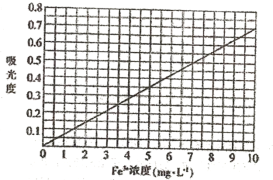
①配制Fe3+浓度为0.1 mg/mL的标准溶液100mL。称取________(精确到0.1)mg高纯度的硫酸铁铵[(NH4)Fe(SO4)2·12H2O],加入20.00 mL经处理的去离子水。振荡溶解后,加入2 mol·L-1HBr溶液1mL和1mol·L-1KSCN溶液0.5mL,加水配成100mL溶液。
②将上述溶液稀释成浓度分别为0.2、1.0、 3.0、5.0、 7.0、 10.0(单位: mg·L-1)的溶液。分别测定不同浓度溶液对光的吸收程度(吸光度),并将测定结果绘制成如图所示曲线。取硫酸亚铁铵产品,按步骤①配得产品硫酸亚铁铵溶液10mL,稀释至100mL,然后测定稀释后溶液的吸光度,两次测得的吸光度分别为0.590、0.610,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_______mg·L-1。
(5)称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用c mol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___________(用含c、V、m的代数式表示,化简)。滴定时,下列滴定方式中,最合理的是___________(填字母)。
A.  B.
B. 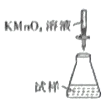 C.
C. 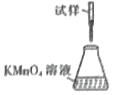
若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果将会_________(填“偏大”“偏小”或“无影响”。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 为直线形结构,
为直线形结构,![]() 为平面正三角形结构,
为平面正三角形结构,![]() 为三角锥形结构,请推测COS、
为三角锥形结构,请推测COS、![]() 、
、![]() 的空间构型:______________________________。
的空间构型:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com