
某学生的实验报告所列出的下列数据中合理的是
A.用10 mL量筒量取7.13 mL稀盐酸
B.用托盘天平称量25.20 g NaCl
C.用25 mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70 mL
D.用广泛pH试纸测得某溶液的pH为2.3
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2016届天津市高三上12月学业调研化学试卷(解析版) 题型:选择题
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是
①过量的锌与18mol/L硫酸溶液反应
②过量的氢气与少量的N2在催化剂存在下充分反应
③浓盐酸与过量的MnO2
④过量的铜与浓硫酸
⑤过量银与稀硝酸
⑥过量的稀盐酸与块状石灰石
A.①④⑤ B.②③⑤ C.②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
既能使石蕊试液变红,又能使品红试液变为无色,还能使溴水褪色的是
A.Cl2 B.H2S C.SO2 D.CO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附属中学高一上三次阶段测化学卷(解析版) 题型:选择题
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行氯气的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
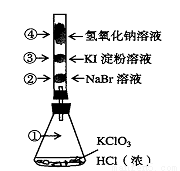
① | ② | ③ | ④ | |
A | 黄绿色 | 橙色 | 蓝色 | 无色 |
B | 无色 | 橙色 | 紫色 | 白色 |
C | 黄绿色 | 橙色 | 蓝色 | 白色 |
D | 黄绿色 | 无色 | 紫色 | 白色 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第二次段考化学试卷(解析版) 题型:选择题
化学与日常生活密切相关,下列有关说法不正确的是
A.过氧化钠作供氧剂
B.葡萄糖酸亚铁可作补铁剂
C.浓硫酸可刻蚀石英制艺术品
D.明矾用作净水剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高一上期中化学试卷(解析版) 题型:选择题
下列属于氧化还原反应的是
A.SO2+H2O=H2SO3
B.H2CO3=CO2↑+H2O
C.2NaOH+H2SO4=Na2SO4+2H2O
D.C+O2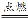 CO2
CO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二12月月考化学试卷(解析版) 题型:选择题
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO32-+I2+H2O”设计成原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是
AsO32-+I2+H2O”设计成原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是

A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变浅
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2+2e-═2I-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川阆中中学校高一上第二次段考化学试卷(解析版) 题型:填空题
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1) 不做任何实验就可以肯定原溶液中不存在的离子是 。
(2) 取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是 ,有关的离子方程式为 。
(3) 取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有 ,有关的离子方程式为 。
(4) 原溶液可能大量存在的阴离子是下列的 。(填序号)
A.Cl- B.NO3- C.CO32- D.OH-
查看答案和解析>>
科目:高中化学 来源:2015-2016年湖南湘潭、岳阳两校高二上第三次联考化学卷(解析版) 题型:填空题
化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
则ΔH1﹤ΔH2
②H2(g)+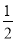 O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。
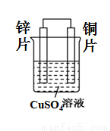
请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。
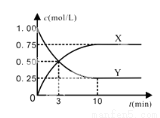
回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
A.容器内各气体的体积分数保持不变
B.混合气体密度不变
C.3v逆(CH3OH) =v正(H2)
D.混合气体的平均相对分子质量不变
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。
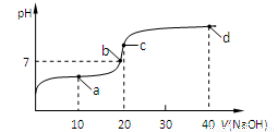
①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com