
SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是__________。(结合有关平衡方程式简要说明)
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A ________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。

(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)

操作步骤 | 实验现象 | 解释原因 |
关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①____ |
若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2=2Na2SO3+O2 | |
关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中。 | E中②__________ | E中反应的离子方程式③________ |
F中④__________ | F中反应为2OH-+SO2=SO32-+H2O |
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源:2017届河北省张家口市高三第一学期期末教学质量监测化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 溶液和胶体的本质区别为是否能产生丁达尔效应
B. K2Cr2O7溶液和氢溴酸能存放于同一药品橱内
C. 用带玻璃塞的细口试剂瓶保存氢氟酸
D. CH4和C2H4均属于常用危险品中的易燃气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市北校区高一下学期第一次月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示,下列说法正确的是
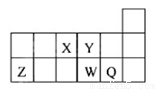
A. 离子Y2-和Z3+的核外电子数和电子层数都不相同
B. 原子半径的大小顺序为rX>rY>rZ>rW>rQ
C. 元素X与元素Z的最高正化合价之和的数值等于8
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市北校区高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列说 法正确的是
法正确的是
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na和Cs属于第IA族元素,Cs失电子能力比Na强
D.P和As属于第VA族元素,H3PO4酸性比H3AsO4弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市北校区高一下学期第一次月考化学试卷(解析版) 题型:选择题
我国稀土资源丰富。下列有关稀土元素 Sm与
Sm与 Sm的说法正确的是
Sm的说法正确的是
A.  Sm与
Sm与 Sm互为同位素 B.
Sm互为同位素 B.  Sm与
Sm与 Sm的化学性质不同
Sm的化学性质不同
C.  Sm与
Sm与 Sm是同一种核素 D.
Sm是同一种核素 D.  Sm与
Sm与 Sm的核外电子数和中子数均为62
Sm的核外电子数和中子数均为62
查看答案和解析>>
科目:高中化学 来源:2017届安徽省安庆市高三第二次模拟考试理科综合化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法不正确的是
A. 1,2-二甲苯也称邻二甲苯
B. 氨基乙酸与a-氨基丙酸的混合物一定条件下脱水能生成4种二肽
C. 苯与溴水不能发生加成反应,所以两者混合后无明显现象
D. C5H10O2属于羧酸的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:简答题
工业废水中常含有一定量Cr2O72-和CrO42-,它们会对人类及生态系统产生很大伤害。
已知:i. 2CrO42-(黄色)+ 2H+  Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
ii. Cr(OH)3(s) + H2O  [Cr(OH)4]- (亮绿色) + H+
[Cr(OH)4]- (亮绿色) + H+
(1) 含铬工业废水的一种处理流程如下:
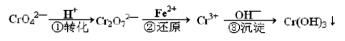
① i. 若在转化一步中调节溶液的pH=2,则溶液显_______色。
ii. 能说明转化一步反应达平衡状态的是_______(填字母序号)。
a.Cr2O72-和CrO42-的浓度相同 b.ν正(Cr2O72-) = 2ν逆(CrO42-)
c.溶液的颜色不变 d.溶液的pH不变
② 步骤②还原一步的离子方程式是___________________________;若还原l mol Cr2O72-离子,需要FeSO4·7H2O的物质的量是_______mol。
③ 沉淀一步中,向含Cr3+(紫色)溶液中,逐渐滴加NaOH溶液。当pH=4.6时,开始出现灰绿色沉淀,随着pH的升高,沉淀量增多。当pH≥13时,沉淀逐渐消失,溶液变为亮绿色。
i. 请解释溶液逐渐变为亮绿色的原因:_______。
ii. 若向0.05mol·L-1的Cr2(SO4)3溶液50mL中,一次性加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象是__________。
④ 在K[Cr(OH)4]和K2Cr2O7混合溶液中加入足量H2SO4酸化,铬元素以_______形式存在(填离子符号)。
(2) 用Fe做电极电解含Cr2O72-的酸性工业废水,可以直接除去铬。随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
① 结合上述工业流程分析用Fe做电极的原因:_______。
② 结合电极反应式解释在阴极附近溶液pH升高的原因:_______。
③ 溶液中同时生成的沉淀可能还有_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三2月模拟理科综合化学试卷(解析版) 题型:选择题
苯胺是染料工业的重要原料,因其毒性强,在环境中对苯胺类化合物应严格控制排放。下 列关于苯胺(C6H5NH2)结构和性质的说法中不正确的是
A. 碳原子和氮原子均采取Sp2杂化 B. 分子中既有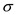 键又有
键又有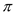 键
键
C. 能发生加成反应和取代反应 D. 既能与盐酸反应,又能被氧化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市南校区高一3月月考化学试卷(解析版) 题型:选择题
M2+ 离子有2个电子层,则M在周期表的位置是
A. 第二周期零族 B. 第二周期Ⅷ族
C. 第二周期ⅡA族 D. 第三周期ⅡA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com