
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列有关说法正确的是( )

A.c点对应的溶液中大量存在的离子可能为:Na+、H+、Cl-、NO3-
B.将25℃时的KCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点
C.t℃<25℃
D.ac线上的任意一点溶液均有c(H+)=c(OH-)
科目:高中化学 来源:2015-2016学年贵州省高二上学期期中理化学试卷(解析版) 题型:选择题
化学反应的本质是旧键断裂和新键形成的过程,下列关于化学反应叙述错误的是( )
A.放热反应△H < 0,吸热反应△H>0
B.化学键断裂释 放能量,化学键形成吸收能量
放能量,化学键形成吸收能量
C.木炭的燃烧是放热反应
D.吸热反应的生成物总能量大于反应物总能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省龙岩四校高二上学期期中联考化学试卷(解析版) 题型:实验题
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析。具体步骤如图所示:
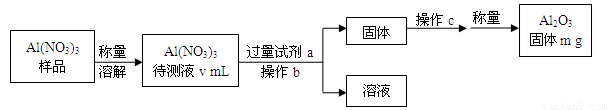
①加入过量氨水后发生反应的离子方程式为:___________________________。
②操作b为:________________。
③Al(NO3)3待测液中,c(Al3+)=___________ mol/L(用含m、V的代数式表示)。
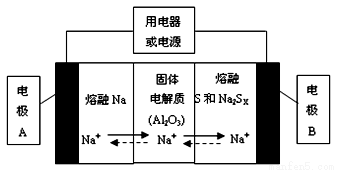
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050、 |
沸点/℃ | 892 | 444.6 | 2980 |
①根据上右表数据,请你判断该电池工作的适宜应控制在____________(填字母)范围内。
A.100℃以下 B.100~300℃ C.300~350℃ D.350~2050℃
②放电时,电极A为_________极,电极B发生_________反应(填“氧化或还原”)
③充电时,总反应为Na2SX=2Na+xS(3<x<5),则阳极的电极反应式为:________________。

(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:________________;试分析左侧溶液蓝色逐渐变浅的可能原因是:_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省龙岩四校高二上学期期中联考化学试卷(解析版) 题型:选择题
下列物质间的反应,其能量变化符合如图所示的是( )
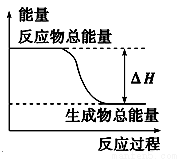
A.铝粉与氧化铁在加热条件下的反应
B.灼热的碳与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.碳与水高温条件下制取水煤气的反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宣城市等四校高二上期中化学卷(解析版) 题型:选择题
如图所示,可逆反应:2A(g)+B(g)  2C(g) △H<0的图像正确的是( )
2C(g) △H<0的图像正确的是( )

查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宣城市等四校高二上期中化学卷(解析版) 题型:选择题
下列设计的实验方案能达到实验目的是( )
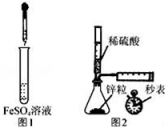
A.制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡
B.测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间
C.中和热测定实验中把盐酸分多次加入氢氧化钠溶液中
D. 酸碱中和滴定实验中锥形瓶需要用待测液润洗
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省、永年二中高一上期中化学卷(解析版) 题型:实验题
用98%的浓硫酸(ρ=1.84g/cm3)配制1mol/L稀硫酸100mL.
(1)实验中应选用的仪器是 (填字母).
A.1000mL量筒 |
B.托盘天平 |
C.玻璃棒 |
D.50mL容量瓶 |
E.10mL量筒
F.50mL烧杯
G.100mL容量瓶
H.胶头滴管
(2)实验操作:
a.用100mL量筒量取98%的浓硫酸 mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2--3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1---2cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用.
(3)实验分析:
①正确的操作步骤是 (填序号).
②此实验中玻璃棒的作用是 .
③实验操作中有两处错误,这两处错误是:
I. .
II. .
④下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
I.转移硫酸后,小烧杯未洗涤 .
II.量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中 .
III.定容时俯视容量瓶刻度线 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省、永年二中高一上期中化学卷(解析版) 题型:选择题
下列实验设计方案中,可行的是( )
A.除去CO2中的少量HCl:通入NaOH溶液
B.除去KCl溶液中的少量K2CO3:加入适量的盐酸
C.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42-
D.用BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省宁德市高一上期中化学试卷(解析版) 题型:填空题
化学计量在化学中占有重要地位。根据计算填空:
(1)1.204×1022个NH3分子的物质的量为_________,在标准状况下的体积为___________mL。
(2)含0.4 mol Fe3+的Fe2( SO4)3中含SO42-的物质的量为__________。
(3)已知8gX与10 g Y恰好完全反应生成0.02 mol Z和15.88 g W,则Z的摩尔质量为_________。
(4)某混合溶液中只含有下列几种离子(不考虑水的电离):Na+、Mg2+、Cl-、SO42-,若Na+、Mg2+、Cl-的物质的量浓度依次为0.2 mol/L、0.25 mol/L、0.5 mol/L,则c(SO42-)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com