
【题目】光呼吸是所有进行光合作用的细胞在光照和高氧低二氧化碳情况下发生的一个代谢过程。它是光合作用一个损耗能量的副反应。即绿色植物在照光条件下的呼吸作用。特点是有机物在被分解转化过程中虽也放出CO2,但不能生成ATP,使光合产物被白白地耗费掉。所以光呼吸越强,光合生产率相对就低。
光呼吸现象产生的分子机制是O2和CO2竞争Rubisco酶。在暗反应中,Rubisco酶能够以CO2为底物实现CO2的固定,而当O2浓度高、CO2浓度低时,O2会竞争Rubisco酶。Rubisco酶以O2为底物,对五碳化合物进行加氧氧化。光呼吸使光合作用产物损失的具体过程如图所示。
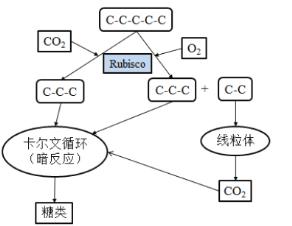
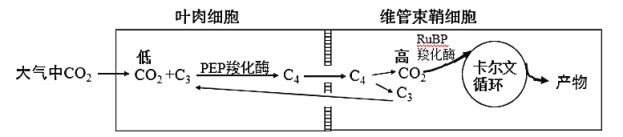
水稻、小麦等C3植物的光呼吸显著,通过光呼吸损耗光合作用新形成有机物的1/4,而高粱、玉米等C4植物的光呼吸消耗很少,只占光合作用新形成有机物的2%~5%。与C3植物相比,C4植物代谢的不同点是,C4植物叶肉细胞的细胞质基质具有一种特殊的PEP羧化酶,它催化如下反应:PEP+HCO3—→苹果酸(C4)+Pi。苹果酸进入维管束鞘细胞,生成CO2用于暗反应,再生出的丙酮酸(C3)回到叶肉细胞中,进行循环利用。叶肉细胞包围在维管束鞘细胞四周,形成花环状结构。PEP羧化酶与CO2的亲和力是Rubisco酶的60倍,也就是PEP羧化酶能固定低浓度的CO2。
水稻和小麦作为养活全世界几乎40%人口的主要作物,它们的产量近几年越来越难满足全球快速增长的食物需求。目前,国际上有很多科研人员致力于提高水稻、小麦的光合速率的研究,旨在提高粮食作物产量。
(1)在光呼吸过程中,有机物被氧化分解,却无ATP生成,而ATP能应用于___________________(写出三条)等生命活动中,故会造成有机物浪费的结果。
(2)有观点指出,光呼吸的生理作用在于高温天气和过强光照下,蒸腾作用过强,植物失水过多,____________大量关闭,导致CO2供应减少。此时的光呼吸可以消耗光反应阶段生成的多余的____________,并且光呼吸的最终产物还可以作为暗反应阶段的原料,这是有重要正面意义的。
(3)综合文中信息,请解释C4植物光呼吸比C3植物小很多的原因__________。
(4)请根据高中所学知识和本文中的信息,在基因水平上写出两条具体的提高水稻、小麦光合作用的研究思路__________。
【答案】根吸收无机盐、细胞分裂、DNA复制等 气孔 [H]和ATP 即使在低CO2浓度下,C4植物叶肉细胞中高效的PEPC酶能够利用极低浓度的CO2,且花环状的结构使得多个叶肉细胞中的CO2富集到一个维管束鞘细胞中,使得维管束鞘细胞CO2浓度高,在竞争Rubisco酶中有优势,抑制光呼吸 利用基因工程技术在水稻、小麦中引入C4途径的相关基因;改造Rubisco酶的基因进而改变Rubisco酶结构,使得只特异性结合CO2
【解析】
植物的光合作用原理是在叶绿体里利用光能把二氧化碳和水合成有机物并放出氧气,同时把光能转变成化学能储存在制造的有机物里,光合作用又分为光反应和暗反应,光反应的物质变化有水的光解和ATP的合成,暗反应的物质变化为二氧化碳的固定和三碳化合物的还原,影响光合作用的环境因素有温度、二氧化碳浓度及光照强度,据此解答。
(1)ATP是细胞生命活动的直接能源物质,故ATP可用于多种生命活动,如根吸收无机盐、细胞分裂、DNA复制等。
(2)植物细胞吸收二氧化碳是从气孔进入细胞。如果蒸腾作用过强,植物失水过多,气孔大量关闭,导致CO2供应减少,此时暗反应受阻。有光照,光反应继续产生[H]和ATP,此时光呼吸可以消耗光反应阶段生成的多余的[H]和ATP,同时光呼吸的最终产物还可以作为暗反应阶段的原料,这是有重要正面意义的。
(3)此问需要结合两个内容,一是C4途径的特点,二是光呼吸的分子机制。首先,C4的特点是为Rubisco酶提供高浓度CO2。这个实现的条件有两点,①PEP羧化酶固定CO2能力强;②固定的这些CO2被花环状结构富集与维管束鞘细胞中。第二,高浓度的CO2能够竞争Rubisco酶,避免O2与Rubisco酶结合进而避免光呼吸的产生;所以C4植物光呼吸比C3植物小很多。
(4)通过基因工程原理,在基因水平上提高水稻、小麦光合作用的研究思路:一、利用基因工程技术在水稻、小麦中引入C4途径的相关基因;二改造Rubisco酶的基因进而改变Rubisco酶结构,使得只特异性结合CO2。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】“结构决定性质”是化学科学的重要理论。
(1)下列关于基态O原子结构的相关描述中错误的是________。
A.轨道表达式(电子排布图)为![]() B.有2个未成对电子
B.有2个未成对电子
C.电子占据最高能级的电子云轮廓图为哑铃(纺锤)形 D.价电子数为4
(2)Na的焰色反应为黄色,其原因是________。
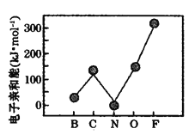
(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的电子亲和能E1变化趋势如图所示。氮元素的E1呈现异常的原因是________。
(4)K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___。
(5)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ· mol-1,下列说法或热化学方程式正确的是

A.C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ· mol-1
B.拆开1mol金刚石和1mol O2中的化学键需要吸收395.4kJ的热量
C.金刚石的稳定性强于石墨
D.石墨的总键能比金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业,是难溶于水的白色固体,能溶解于硝酸,在潮湿空气中可被迅速氧化。
Ⅰ.实验室用CuSO4—NaCl混合液与Na2SO3溶液反应制取CuCl。相关装置及数据如图:
图甲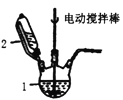 图乙
图乙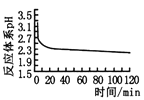 图丙
图丙
回答以下问题:
(1)甲图中仪器1的名称是________;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂应为_____________。
(2)乙图是体系pH随时间变化关系图,写出制备CuCl的离子方程式_____________。丙图是产率随pH变化关系图,实验过程中往往用Na2SO3—Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是_______并维持pH在______左右以保证较高产率。
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是________。
Ⅱ.工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
A.  CuCl的盐酸溶液 B.
CuCl的盐酸溶液 B.  Na2S2O4和KOH的混合溶液
Na2S2O4和KOH的混合溶液
C.  KOH溶液 D.
KOH溶液 D. 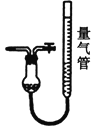
已知:Na2S2O4和KOH的混合溶液可吸收氧气。
(4)装置A中用盐酸而不能用硝酸,其原因是__________(用化学方程式表示)。用D装置测N2含量,读数时应注意________。整套实验装置的连接顺序应为_______________→D。
查看答案和解析>>
科目:高中化学 来源: 题型:
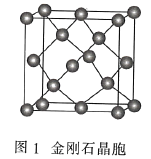
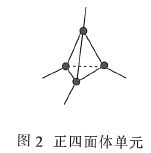
【题目】碳的同素异形体有很多,我国科学家成功地合成了通过理论计算预言的T-碳。回答下列问题:
(1)基态碳原子价层电子的轨道表达式(电子排布图)为________。
(2)石墨炔可由六炔基苯![]() 在铜片的催化作用下发生偶联反应得到。
在铜片的催化作用下发生偶联反应得到。
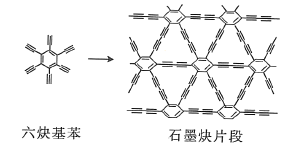
六炔基苯分子中的所有原子________(填“能”或“不能”)处于同一平面,六炔基苯属于________(填“极性”或“非极性”)分子,1个六炔基苯分子中含有![]() 键的数目为________。
键的数目为________。
(3)金刚石(图1)中的每个碳原子用一个由4个碳原子组成的正四面体的结构单元(图2)取代,即得到T-碳。T-碳可通过皮秒激光照射悬浮在甲醇溶液中的多壁碳纳米管(图3)制得。多壁碳纳米管和T-碳中碳原子的杂化方式依次为________、________;溶剂甲醇中三种元素的电负性由大到小的顺序为________(用元素符号表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
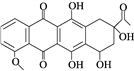
A. 每个柔红酮分子中含有2个手性碳原子
B. 柔红酮分子中所有的碳原子都在同一个平面上
C. 1 mol柔红酮最多可与2 mol Br2发生取代反应
D. 一定条件下柔红酮可发生氧化、加成、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知辉铜矿、软锰矿的主要成分如下表所示:
矿石 | 辉铜矿 | 软锰矿 |
主要成分 | Cu2S、Fe2O3、SiO2 | MnO2、SiO2 |
某化工厂拟以这两种矿石为原料采用湿法冶炼铜,工艺如下:

回答下列问题:
(1)气体 X 遇浓硝酸产生“白烟”,写出气体 X 的电子式:______________________________。
(2)提高“酸浸”速率的措施有______________________________(填两条)。
(3)用离子方程式表示“酸浸”中 MnO2 的作用:______________________________,被氧化的元素是______________________________(填元素符号)。
(4)已知 CH3COONH4 溶液呈中性,则常温下,NH4HCO3 溶液 pH______________________________(填“>”、“<”或“=”)7,理由是__________。
(5)从滤液 C 中可以提取一种化学肥料,它的化学式为_____________________________。
(6) 从溶液中析出的碱式碳酸铜可能带有结晶水,设其通式为 Cu2(OH)2CO3·xH2O。准确称取a g 样品,灼烧至恒重,称得 CuO 的质量,固体质量减轻 b g,则 x 为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
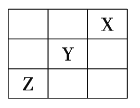
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了解有机物A的性质,对A的结构进行了如下实验。
实验一:通过质谱分析仪分析得知有机物A的相对分子质量为90。
实验二:用红外光谱分析发现有机物A中含有—COOH和 —OH。
实验三:取1.8g有机物A完全燃烧后,测得生成物为2.64gCO2和1.08gH2O。
实验四:经核磁共振检测发现有机物A的谱图中H原子峰值比为3:1:1:1。
(1)有机物A的结构简式为_______。
(2)有机物A在一定条件下可以发生的反应有_______。
a.消去反应 b.取代反应 c.聚合反应 d.加成反应 e.氧化反应
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B的分子式为C3H4O2,B能和溴发生加成反应,则B的结构简式为_______。另一种产物C是一种六元环状酯,写出生成C的化学方程式:_______。
(4)写出A与足量的金属钠反应的化学方程式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com