
【题目】某烃A蒸气的密度是相同状况下氢气密度的36倍,已知该烃中的碳氢元素质量比为5:1,求:
(1)该烃的相对分子质量为______;
(2)确定该烃的分子式为______;
(3)该烃的同分异构体有______种。
【答案】 72 C5H12 三种
【解析】根据相对密度可得该烃的相对分子质量,结合碳氢元素的质量比可确定其分子式,根据碳链异构的书写原则可判断其同分异构体的种类。
(1)已知烃A蒸气的密度是相同状况下氢气密度的36倍,则烃A的摩尔质量=36×2g/mol=72g/mol,所以该烃的相对分子质量为72。
(2)已知烃A分子中碳氢两元素的质量比为5:1,1mol烃A的质量为72g,烃A分子中含C原子数为(![]() ×72)/12=5,含H原子数为(
×72)/12=5,含H原子数为(![]() ×72)/1=12,则烃A的分子式为C5H12。
×72)/1=12,则烃A的分子式为C5H12。
(3)根据戊烷的组成,其可能的同分异构体有CH3CH2CH2CH2CH3,CH3CH(CH3)CH2CH3和C(CH3)4三种。


科目:高中化学 来源: 题型:
【题目】反应Fe(s)+CO2(g)FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15.下列说法正确的是( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K= ![]()
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用废弃的铁铝混合物(含Fe、Al、Al2O3、Fe2O3)回收金属铝和铁,实验流程设计如下:
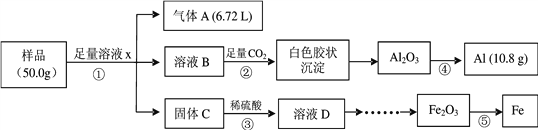
(1)写出①中发生反应的离子方程式___________、_____________。
(2)下列说法正确的是_________。
a. ②中发生的是非氧化还原反应
b. ③中所得溶液D中含有Fe2+和Fe3+
c. ④和⑤分别采用电解法和热还原法
(3)由溶液D制取Fe2O3的实验过程是 ______________。
(4)该样品中Al2O3的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
(1)已知CH3OH(g)+ ![]() O2(g)
O2(g)![]() CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
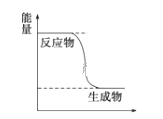
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)=__________ ,则CH3OH的转化率为______ 。
(3)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH(电解质溶液)构成,则下列说法正确的是 ______
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-=CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2mol电子
(4)写出甲醇燃料电池在酸性条件下负极的反应式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)Fe(s)+CO2(g)△H>0
试回答下列问题:
(1)写出该反应的平衡常数表达式 .
(2)升高温度,该反应的平衡常数K值将(填“增大”、“减小”、“不变”),平衡体系中固体的质量将( 填“增大”、“减小”、“不变”).
(3)已知1100℃时该反应的平衡常数K=0.263.在该温度测得高炉中c(CO2)=0.025molL﹣1 , c(CO)=0.1molL﹣1 , 此时该的化学反应速度是v(正) (填“>”、“<”、“=”)v(逆).
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值(填”>”、“<”、“=”)0.263.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,A和B浓度比c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin).
(1)A在5min末的浓度是多少?
(2)B的平均反应速率是多少?
(3)D的平均反应速率是多少?
(4)x值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理膳食、合理用药是人体健康的需要.
①下列营养素中,不能对人体提供能量的是(填字母).
a.维生素 b.糖类 c.蛋白质
②某肉制品包装上印有相关配料如图所示.
其中属于调味剂的是;属于发色剂的是;
属于防腐剂的是 .
③当体内胃酸分泌过多时,医生会建议服用以下常用药物中的(填字母).
a.阿司匹林 b.青霉素片 c.复方氢氧化铝片 d.合成抗菌药.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学。
(1)近年频繁发生的有关化学品泄漏或爆炸事件一次次给我们敲响了安全警钟,操作不当就会存在安全隐患。下列做法正确的是_______________。
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌;
②酒精、钠等着火,可以用水扑灭;
③如果发生氯气泄露,可用沾Na2CO3溶液的湿毛巾捂住口鼻,向上风口或地势高的地方撤离;
④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风;
⑤不慎将浓硫酸沾到皮肤上,要立即用干布拭去,再用大量水冲洗,然后涂上NaOH溶液;
⑥加热液体的试管口不能对着自己或别人;
⑦实验中当有少量的过氧化钠或金属钠剩余时,用纸包裹好后将其放入垃圾桶中
(2)某同学需要配制0.1mol·L-1 的NaHCO3溶液500mL,请根据溶液配制过程中的情况回答下列问题:
①应称取固体NaHCO3的质量为____________________。
②实验中除了托盘天平(带砝码和镊子)、烧杯、药匙、玻璃棒外还需要的其它仪器有_________________________
③定容观察液面时俯视刻度线,所配溶液浓度_______(填“偏高”、“偏低”或“无影响”)
④所配的NaHCO3溶液在保存时,常因温度过高而分解,含有少量Na2CO3,若要除去杂质Na2CO3,最简便的方法是_______,其反应的离子方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com