
现有含I―,Cl―,SO42―,CO32―四种阴离子的稀溶液,为了将它们以沉淀或溶液的形成分离出来,进行了以下操作。

回答:(1)生成A,B,D的离子方程式
(2)向A中加稀硝酸有气泡产生,写出离子方程式
(3)溶液E中含有哪些阴离子。
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

|
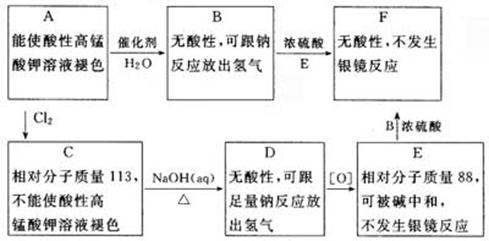
试写出化合物A、F的结构简式:____________、____________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省实验中学高二上学期期中化学试卷(带解析) 题型:填空题
(15分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。2001年我国卫生部规定,饮用水中ClO2—的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2—的含量可用连续碘量法进行测定。CIO2被I—还原为CIO2—、Cl—的转化率与溶液pH的关系如下图所示。当pH≤2.0时,CIO2—也能被I—完全还原成Cl—。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2==Na2S4O6+2NaI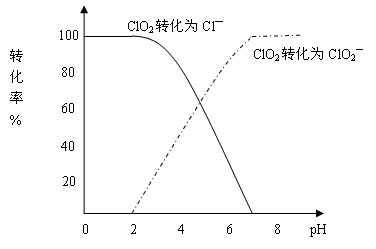
①请写出pH≤2.0时,CIO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的K I晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为
④根据上述分析数据,测得该饮用水样中CIO2—的浓度为 mol·L-1(用含字母的代数式表示。)
⑤若饮用水中ClO2— 的含量超标,可向其中加入适量的Fe2+将ClO2— 还原成Cl—-, 请猜测该反应的氧化产物是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三毕业班教学质量检查理综化学试卷(解析版) 题型:实验题
实验室可用MnO2和KClO3混合加热的方法制取氧气:2KClO3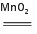 2KCl+3O2↑
2KCl+3O2↑
I.现有下列仪器或装置:
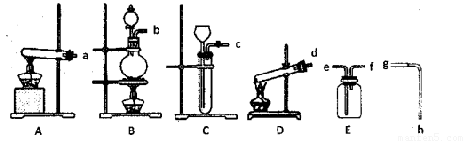
(1)A-D装置中,用作KClO3为原料制氧气的反应装置是____(填序号)。
(2)排水法收集氧气,接口顺序是:氧气出口→___→___→g→h→烧杯(填序号)。
Ⅱ.KClO3分解时尚有副反应,导致收集到的气体有异味。据推测,副产物可能是O3、Cl2、ClO2中的一种或几种。资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2。为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入如右装置进行实验:
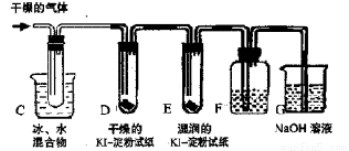
(3)若要确认副产物中含Cl2,F中应盛放_____溶液。
(4)确定副产物中含有ClO2的现象是_________________。
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有臭氧的结论?
答:_____ (填“能”或“不能”)。理由是________________________________。
Ⅲ.ClO2是饮用水消毒剂。用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-。为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I- =I2+2ClO2-,反应结束后产生amolI2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I- =2I2+Cl-+2H2O,反应结束后叉产生bmolI2。
(6)饮用水中c(ClO2-)=_____________mol·L- 1(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com