
利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是( )

A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
科目:高中化学 来源:2016-2017学年吉林省高二上学期期中化学试卷(解析版) 题型:填空题
在下列事实中,什么因素影响了化学反应速率:
(1)1mol/l和0.1mol/l的HCL分别和锌反应:_______________________。
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:_______________________。
(3)夏天的食品易霉变,而冬天不易发生该现象:________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上9月月考化学试卷(解析版) 题型:选择题
下列与社会、生活有关的说法不正确的是 ( )
A.绿色化学的核心是从源头上减少和消除化工生产对环境的污染
B.减少化石燃料使用,有利于降低空气中PM2.5的值
C.淀粉、豆油、蛋白质都是天然高分子化合物
D.“地沟油”禁止食用,但可以用来制肥皂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省青岛市高一上月考一化学试卷(解析版) 题型:选择题
如图所示,将氯气通入装置。若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色。则a溶液(足量)是

A.碳酸钠溶液 B.浓硫酸
C.饱和食盐水 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高二上第一次质检化学卷(解析版) 题型:填空题
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:

(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 .若所盛溶液为KCl溶液:则B极的电极反应式为 .
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);B电极上的电极反应式为 ,总反应化学方程式是 .
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),电极反应式是 ,反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”).
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高二上第一次质检化学卷(解析版) 题型:选择题
一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
锌片:2Zn﹣4e﹣+4OH﹣═2ZnO+2H2O 石墨:2H2O+O2+4e﹣═4OH﹣
下列说法中不正确的是( )
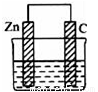
A.电子从石墨经外电路流向锌片,电解质溶液为酸性溶液
B.锌片是负极,石墨是正极
C.电池总反应为2Zn+O2═2ZnO
D.该原电池工作一段时间后石墨附近溶液中的c(OH﹣)增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高二上第一次质检化学卷(解析版) 题型:选择题
下列关于电化学的实验事实正确的是( )
出现环境 | 实验事实 | |
A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
B | 电解CuCl2溶液 | 电子 |
C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
D | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海省高一上月考一化学试卷(解析版) 题型:选择题
对于质量相同的CH4和O2,下列说法正确的是 ( )
A.所含分子个数相等 B.物质的量相等
C.所含原子个数之比为5:1 D.体积之比为2:1
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上学期调研模拟二化学试卷(解析版) 题型:简答题
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g) CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)  CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。

① 下列说法正确的是____________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,ΔH > 0
D.反应中,催化剂使平衡向正反应方向移动
② p2 p1 (填“大于”、“小于”或“等于”);
③ 100 ℃时,该反应的化学平衡常数K=____ ____;
(3)某科研小组用SO2为原料制取硫酸。
① 利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:___________________。
② 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com