
 研究性学习小组进行溴乙烷的制备的相关探究实验.
研究性学习小组进行溴乙烷的制备的相关探究实验.| 所用试剂及操作方法 | 实验现象及结论 | |
| 1 | ||
| 2 |
| △ |
| △ |
| 所用试剂及操作方法 | 实验现象及结论 | |
| 1 | 将A中逸出的气体通入溴的CCl4溶液 | 若溶液褪色,则逸出的气体含乙烯 |
| 2 | 将A中逸出的气体通入品红溶液 | 若溶液褪色,则逸出的气体含SO2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:查看答案和解析>>
科目:高中化学 来源: 题型:
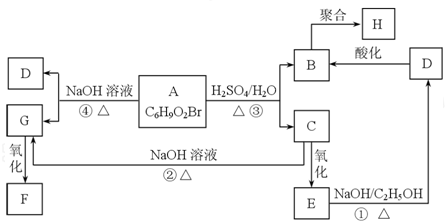
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C、化学反应中的能量变化通常表现为热量变化 |
| D、已知Zn与稀硫酸的反应是放热反应,则1mol Zn与1mol H2SO4的总能量大于1mol ZnSO4与1mol H2的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com