
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.半导体材料
科目:高中化学 来源: 题型:
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |
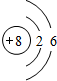
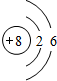
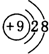

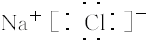
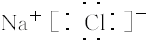
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| W | X | Y | Z | |
| 结构 或性质 |
最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正化合价与最低负化合价之和为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:
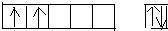
(1)钛元素的同位素有:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
A.据此可计算出钛元素的相对原子质量为48
B.钛元素的五种同位素化学性质均不相同
C.钛元素在元素周期表中位于第四周期
D.钛与26Fe同为第Ⅷ族元素
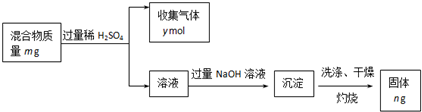
(2)TiO2是高级的白色颜料,它的制取方法如下:
第一步:使钛铁矿与硫酸反应,FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O,此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使将生成的Fe3+还原成Fe2+。写出此还原过程的离子反应方程式:______________________________________________________。
TiOSO4+FeSO4+2H2O,此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使将生成的Fe3+还原成Fe2+。写出此还原过程的离子反应方程式:______________________________________________________。
第二步:水解,TiOSO4+2H2O![]() TiO2·H2O+H2SO4 ΔH>0。
TiO2·H2O+H2SO4 ΔH>0。
制TiO2的关键是第二步水解反应。为使第二步水解反应进行得更完全,可采用下列_______措施。
A.加酸 B.加碱 C.加热 D.加压
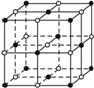
(3)最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子。则它的化学式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com