
【题目】法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法错误的是

A.法匹拉韦的分子式为C5H4N3O2F
B.法匹拉韦最多能与4 mol H2发生加成反应
C.法匹拉韦在一定条件下能与NaOH溶液发生反应
D.法匹拉韦能使酸性高锰酸钾溶液褪色
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】过碳酸钠是一种多用途的新型漂白剂,化学式可表示为aNa2CO3·bH2O2,过碳酸钠溶于水分解成Na2CO3和H2O2。
(1)FeOCl常用作过碳酸钠使用时的催化剂。FeCl3·6H2O在250℃时分解可得到FeOCl,该反应的化学方程式为______________________________________。
(2)测定某样品中过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
步骤Ⅰ:称取样品0.800 0 g于锥形瓶中,加水溶解,滴加甲基橙作指示剂,用0.200 0 mol·L-1H2SO4溶液滴定至终点,消耗硫酸25.00 mL。
步骤Ⅱ:另称取样品0.800 0 g于锥形瓶中,加水溶解,加稀硫酸酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点(滴定过程中MnO被还原为Mn2+),消耗KMnO4溶液30.00 mL。
①步骤Ⅰ中,滴定终点的现象是____________________。
②步骤Ⅱ中,若样品溶于水酸化后放置一段时间,然后再进行滴定,则过碳酸钠化学式中a∶b的测定结果将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该过碳酸钠化学式(写出计算过程)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.用K3[Fe(CN)6]检验Fe2+的离子反应方程式:2Fe(CN)63- + 3Fe2+= Fe3[Fe(CN)6]2 ↓
B.含氟牙膏防治龋齿的原理是氟离子会跟羟基磷灰石发生沉淀转化生成氟磷灰石的离子反应方程式:Ca5(PO4)3(OH) +F- ![]() Ca5(PO4)3F +OH -
Ca5(PO4)3F +OH -
C.用TiCl4制备TiO2的化学方程式:TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
D.已知在重铬酸钾溶液中存在着如下平衡:Cr2O72-+ H2O![]() H++ 2CrO42-
H++ 2CrO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1 mol·L-1 KOH 溶液滴定 10 mL 0.1 mol·L-1 HA(Ka =1.0×10-5)溶液的滴定曲线如图所示。下列说法正确的是( )
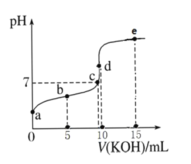
A.a 点溶液的 pH 约为 5
B.水的电离程度:c 点>d 点
C.b 点溶液中粒子浓度大小: c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e 点溶液中:c(K+)=2c(A-)+2c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴、铜及其化合物用途非常广泛。回答下列问题:
(1)基态Br原子核外电子排布式为[Ar]___。
(2)已知反应:Cu(BF4)2.6H2O+Cu+8CH3CN=2[Cu(CH3CN)4]BF4+6H2O。
①配合物[Cu(CH3CN)4]BF4中,与铜形成配位键的原子是___,BF4-的空间构型是___,与BF4-互为等电子体的分子有___(任写一种)。
②CH3CN分子中碳原子的杂化方式是___;1个CH3CN分子中含有___个σ键。
(3)电子亲合能与电离能相对应,元素的气态基态原子获得一个电子成为气态一价负离子所释放的能量称为该元素的第一电子亲合能,其大小主要取决于原子的有效核电荷、原子半径和原子的电子构型等因素。Br与F、Cl位于同一主族,第一电子亲合能(如图1所示)原比氯和溴都小,其原因是___。
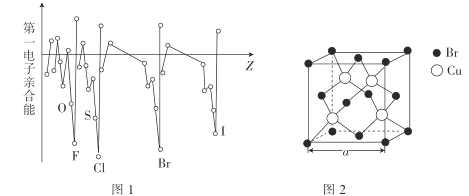
(4)溴化亚铜(晶胞结构如图2所示)可用作有机合成的催化剂,密度为4.71g·cm-3。
①晶胞中Br-的配位数为___。
②晶胞参数a=___(列出表达式即可)nm。(设NA为阿伏加德罗常数的数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)如图是自来水表的常见安装方式,发生腐蚀过程中,电流从_______ (填“接头流向水表”或“水表流向接头”)。

(2)某二次电池放电的电池反应为2Fe+O2+2H2O = 2Fe(OH)2。反应结束时,电极a的质量__________(填“减小”“不变”或“增加”),该电池的正极反应式为____________。

(3)有如图装置:

①图1中,用惰性电极电解过程中的实验数据如图,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中图1装置中产生气体的总体积(标准状况)。电解过程中转移n(e-)=0.4mol,b电极的实验现象为_______________;Q点时,a电极收集到的气体体积为________________。

②图2中,装置通电后,溶液仍然保持澄清,铁电极附近呈紫红色(已知FeO42-在水溶液中呈紫红色),Fe电极上发生的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入5 mol CO和4 mol NO,发生反应: 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,图1为平衡时NO的体积分数与温度、压强的关系。同时为探究催化剂对CO、NO转化率的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。下列说法中正确的是
N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,图1为平衡时NO的体积分数与温度、压强的关系。同时为探究催化剂对CO、NO转化率的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。下列说法中正确的是
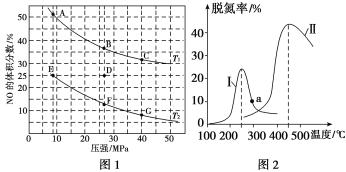
A.温度:T1<T2
B.若在D点对反应容器降温的同时缩小体积使体系压强增大,重新达到的平衡状态可能是图中G点
C.E点时NO的平衡转化率为50%
D.a点是对应温度下的平衡脱氮率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的K2S、KOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS、S2)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是
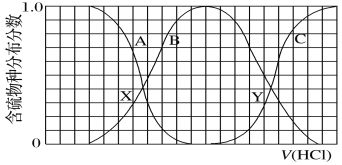
A.A曲线表示S2-随盐酸加入量增加时的分布分数改变情况
B.X、Y为曲线两交叉点。若已知Y点处的pH,则可计算Ka1(H2S)
C.X、Y点对应溶液中水的电离程度大小关系为:X<Y
D.Y点对应溶液中c(K+)与含硫各微粒浓度的大小关系为:c(K+)=3[c(H2S)+c(HS)+c(S2)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 转变为
转变为![]() 的方法为
的方法为
A.溶液加热,通入足量的HCl
B.与稀H2SO4 共热后,加入足量的NaHCO3 溶液
C.与足量的NaOH 溶液共热后,再用稀H2SO4 酸化
D.与稀 H2SO4 共热后,加入足量的NaOH 溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com