
��Ӧ�� Fe(s)+CO2(g)===FeO(s)+CO(g)����H1= a kJ��mol-1
��Ӧ�� CO(g)+1/2O2(g)===CO2(g)����H2= b kJ��mol-1
����ڲ�ͬ�¶��£����ܱ������н��еķ�Ӧ�ٵ�ƽ�ⳣ��Kֵ���¶ȵı仯���£�
![]()
��1����Ӧ�ٵĻ�ѧƽ�ⳣ������ʽΪ ��a 0���>������<����=������ �� 500��2L �ܱ������н��з�Ӧ�٣�Fe �� CO2����ʼ���ʵ�����Ϊ4mol��10min��ﵽƽ��״̬��ƽ��ʱCO2��ת����Ϊ ����CO��ʾ�Ļ�ѧ��Ӧ����Ϊ ��
��2��700�淴Ӧ�ٵ�ƽ�⣬Ҫʹ��ƽ�������ƶ���������������ʱ�����Բ�ȡ�Ĵ�ʩ�� ������ţ���
A����С��Ӧ����� B��ͨ��CO2 C�������¶ȵ�900�� D��ʹ�ú��ʵĴ���
��3������ͼ����Ϸ�Ӧ�ٵ��� ������ţ���ͼ��v�����ʡ�![]() Ϊ�������CO�ĺ�����TΪ�¶ȣ���
Ϊ�������CO�ĺ�����TΪ�¶ȣ���
 |
��4���ɷ�Ӧ�ٺ͢ڿ���÷�Ӧ2Fe(s)+O2(g)===2FeO(s) ��H3�еġ�H3= ���ú�a��b�Ĵ���ʽ��ʾ����
��5������ͼ�Ǽ״�ȼ�ϵ�أ��������ҺΪKOH��Һ���Ľ�ʾ��ͼ����a��ͨ�����
 ����״���������������b���缫�Ϸ����ĵ缫��Ӧ�ǣ�
����״���������������b���缫�Ϸ����ĵ缫��Ӧ�ǣ�
 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������������Ժ�CO2������Ӧ��
Fe(s)+CO2(g)![]() FeO(s)+CO(g)����H>0
FeO(s)+CO(g)����H>0
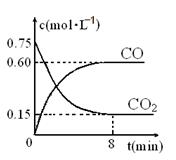
��1��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ����8������CO��ƽ����Ӧ����v(CO)= ��
��2�����д�ʩ����ʹƽ��ʱc(CO)/c(CO2)������� ������ţ���
A�������¶� B������ѹǿ C������һ�������� D���ټ���һЩ����
��3����Ӧ�ﵽƽ��������������������ʱ����ͨ��������CO2����CO2��ת���ʽ�
�����������С���������䡱��
��4��������Ҫ������������������Ӧ��ʮ�ֹ㷺��
��FeSO4��Һ���Թ�����NH4HCO3��Һ��ϣ��ɵú�FeCO3����Һ����FeCO3��Һ��ʱ�䱩¶�ڿ����У����������Ϊ���ɫ��д����FeCO3���ɺ��ɫ���ʵķ�Ӧ�Ļ�ѧ����ʽ�� ��
�ڸ�������(Na2FeO4)��һ����������ˮ������������������������֮һ�ǣ�ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ���������÷�Ӧ�����ӷ���ʽΪ ��
��5����֪��2CO(g) + O2(g) == 2CO2(g)����H=��566 kJ��mol-1
2H2(g) + O2(g) == 2H2O(g)����H=��483.6 kJ��mol-1
д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ:
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������������Ժ�CO2������Ӧ��
Fe(s)+CO2(g)FeO(s)+CO(g)����H>0
��1��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ����8������CO��ƽ����Ӧ����v(CO)= ��
��2�����д�ʩ����ʹƽ��ʱc(CO)/c(CO2)������� ������ţ���
A�������¶� B������ѹǿ C������һ�������� D���ټ���һЩ����
��3����Ӧ�ﵽƽ��������������������ʱ����ͨ��������CO2����CO2��ת���ʽ�
�����������С���������䡱��
��4��������Ҫ������������������Ӧ��ʮ�ֹ㷺��
��FeSO4��Һ���Թ�����NH4HCO3��Һ��ϣ��ɵú�FeCO3����Һ����FeCO3��Һ��ʱ�䱩¶�ڿ����У����������Ϊ���ɫ��д����FeCO3���ɺ��ɫ���ʵķ�Ӧ�Ļ�ѧ����ʽ�� ��
�ڸ�������(Na2FeO4)��һ����������ˮ������������������������֮һ�ǣ�ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ���������÷�Ӧ�����ӷ���ʽΪ ��
��5����֪��2CO(g) + O2(g)== 2CO2(g)����H=��566kJ��mol-1
2H2(g) + O2(g) == 2H2O(g)����H=��483.6kJ��mol-1
д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ:
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����и���Ԫ�µ������ۻ�ѧ�Ծ��������棩 ���ͣ������
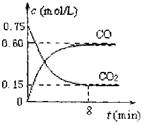
һ�������������Ժ�CO2������Ӧ��Fe(s)��CO2(g) FeO(s)��CO(g)��H��0��1100��ʱ����ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
FeO(s)��CO(g)��H��0��1100��ʱ����ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
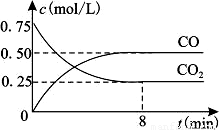
��1�����д�ʩ����ʹƽ��ʱK�������___________������ţ���
A�������¶�??? B������ѹǿC������һ����COD�������¶�
��2��8�����ڣ�CO��ƽ����Ӧ����v��CO��=___________mol/(L��min)��
��3��1100��ʱ��2L���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й���������
���� | �� | �� |
��Ӧ��Ͷ���� | 3molFe��2molCO2 | 4molFeO��3molCO |
CO��Ũ��(mol/L) | C1 | C2 |
CO2��������� |
|
|
��ϵѹǿ��Pa�� | P1 | P2 |
��̬��Ӧ���ת���� |
|
|
������˵����ȷ����___________��
A��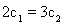 B��
B��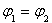 C��P1��P2D��
C��P1��P2D��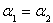
����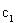 ��___________��
��___________�� ��___________��
��___________��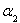 ��___________��
��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�������ʡ�����߿�����ѵ���⣨���ۣ���ѧ���� ���ͣ������
һ�������������Ժ�CO2������Ӧ��
Fe(s)+CO2(g) FeO(s)+CO(g)����H>0
FeO(s)+CO(g)����H>0
��1��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ����8������CO��ƽ����Ӧ����v(CO)= ��
��2�����д�ʩ����ʹƽ��ʱc(CO)/c(CO2)������� ������ţ���
A�������¶� B������ѹǿ C������һ�������� D���ټ���һЩ����
��3����Ӧ�ﵽƽ��������������������ʱ����ͨ��һ������CO2����CO2��ת���ʽ� �����������С���������䡱�����÷�Ӧ��ƽ�ⳣ��K= ���¶����ߣ�K �����������С���������䡱����
��4��������Ҫ������������������Ӧ��ʮ�ֹ㷺����������(Na2FeO4)��һ����������ˮ������������������������֮һ�ǣ�ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ���������÷�Ӧ�����ӷ���ʽΪ ��
��5����֪��2CO(g)+O2(g)==2CO2(g) ��H=��566 kJ/mol��2H2(g)+O2(g)==2H2O(g) ��H=��483.6 kJ/mol��д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ ��
��6����֪Ksp(Fe(OH)3)= 8´10-38��ij��Һ�к���Fe3��Ũ����0.05mol��L-1�����ҪʹFe(OH)3������ȫpH����Ϊ ����Һ������Ũ��С��1��10-5mol/Lʱ��������ȫ��lg2=0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��㶫ʡ�߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��13�֣�һ�������������Ժ�CO2������Ӧ�� Fe(s)+CO2(g) FeO(s)+CO(g)����H>0
FeO(s)+CO(g)����H>0
��1��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ����8������CO��ƽ����Ӧ����v(CO)= ��
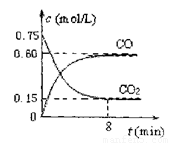
��2�����д�ʩ����ʹƽ��ʱc(CO)/c(CO2)������� ������ţ���
A�������¶� B������ѹǿ C������һ�������� D���ټ���һЩ����
��3����Ӧ�ﵽƽ��������������������ʱ����ͨ��һ������CO2����CO2��ת���ʽ� �����������С���������䡱��
��4��������Ҫ������������������Ӧ��ʮ�ֹ㷺��
��FeCl3��Һ��������Ȼ������дFeCl3��Һ����Ȼ����H2S��Ӧ�����ӷ���ʽ��
��
�ڸ�������(Na2FeO4)��һ����������ˮ������������������������֮һ�ǣ�ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ���������÷�Ӧ�����ӷ���ʽΪ ��
��5����֪��2CO(g)+O2(g)==2CO2(g) ��H=��566 kJ/mol��2H2(g)+O2(g)==2H2O(g) ��H=��483.6 kJ/mol��д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com