
ij��ɫ��Һ��ֻ��������NH4+��K+��Al3+��Mg2+��HCO3����Cl����I����MnO4����SO42���������еļ������ӣ�Ϊ��������ɣ��ֽ�������ʵ�飺
��ȡ10mL����Һ���Թ��еμ�������Ba��N03��2��Һ����ϡ�����ữ����˵õ�0.03mol��ɫ�����ף�
��ȡ������Ӧ�����Һ������AgN03��Һδ������������
����ȡ10mL����Һ���Թ��У��μ�NaOH��Һ������ɫ�����ң�������NaOH�����ʵ���Ϊ0.03molʱ�����������ﵽ������μ�NaOH��Һ�����ȣ���ʼ������������ռ���������������ɱ����Ϊ0.224L�������ȫ���ݳ�������������ȫ�ܽ⣮
�����ƶ���ȷ���ǣ�������
�� A�� �϶���Na+��Mg2+��Al3+��Cl�� B�� �϶���Al3+��SO42����NH4+
�� C�� �϶�û��K+��HCO3����MnO4�� D�� �϶�û��K+��NH4+��Cl��
���㣺 �������ӵļ��鷽�������ӹ������⣮
ר�⣺ ���ӷ�Ӧר�⣮
������ ��Һ��ɫ��˵������MnO4����
��ȡ10mL����Һ���Թ��еμ�Ba��NO3��2��Һ����ϡ�����ữ����˵õ�0.03mol��ɫ�����ף�˵����ΪBaSO4��ԭ��Һ�к���SO42����
������Һ�м���AgNO3��Һδ������������˵��������Cl����I����
����Ϊ���������������ֻ��NH4+��������þ����������������Һ��Al3+��������������Һ��Ӧ���ɳ���������ȫ�ܽ⣬��������̼����������ܷ���˫ˮ�ⷴӦ�����ܴ������棬�ʲ���HCO3��������������������0.01mol�ͱ���°���Ϊ0.224L������Ԫ���غ��֪��NH4+0.01mol��Al3+��0.01mol���ٸ��ݵ���غ����֪����K+�������Ϸ�����֪һ�����е�����ΪK+��NH4+��Al3+��SO42����һ�������е�����ΪMnO4����Mg2+��Cl����I����HCO3����
��� �⣺��Һ��ɫ��˵������MnO4����
��ȡ10mL����Һ���Թ��еμ�Ba��NO3��2��Һ����ϡ�����ữ����˵õ�0.03mol��ɫ�����ף�˵����ΪBaSO4��ԭ��Һ�к���0.01molSO42����
������Һ�м���AgNO3��Һδ������������˵��������Cl����I����
����ȡ��������Һ���Թ��У��μ�NaOH��Һ������ɫ�����ң����������ӵ�һ������ʼ�������������������ȫ�ܽ⣬˵������NH4+��Al3+������Mg2+����Ϊ���������������ֻ��NH4+��������þ����������������Һ��Al3+��������������Һ��Ӧ���ɳ���������ȫ�ܽ⣬��������̼����������ܷ���˫ˮ�ⷴӦ�����ܴ������棬�ʲ���HCO3��������������������0.01mol�ͱ���°���Ϊ0.224L������Ԫ���غ��֪��NH4+0.01mol��Al3+��0.01mol���ٸ��ݵ���غ����֪����K+�������Ϸ�����֪һ�����е�����ΪK+��NH4+��Al3+��SO42����һ�������е�����ΪMnO4����Mg2+��Cl����I����HCO3����
��ѡB��
������ ���⿼��ѧ���������ӵļ��鷽�������Ը��ݳ������ӵ����Ժ�����֮��ķ�Ӧ���ɡ�����غ�ش��Ѷ��еȣ�
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1������ʽ ��ʾ�ķ���ʽ������������������
��ʾ�ķ���ʽ������������������
��2��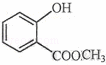 �к��еĹ����ŵ�����Ϊ����
�к��еĹ����ŵ�����Ϊ����
��3��������4���ṹ��ʽΪ��������������������������
��4���������ʵĹ�ҵ�Ҵ�������װ���У����������оƾ��ơ�������������������β�ӹܡ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���г�ȥ���ʵķ�����ȷ���ǣ�������
�ٳ�ȥ�����е���ϩ������������ͨ��Cl2����Һ���룻
�ڳ�ȥ��������������������ñ���̼������Һϴ�ӣ���Һ���������
�۳�ȥ���������ı��ӣ�����������ˮ�����ˣ�
�ܳ�ȥ�Ҵ��������������������ʯ�ң�����
�� A�� �٢� B�� �ڢ� C�� �ڢ� D�� �ۢ�
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ�п��ܺ���H+��NH4+��Mg2+��Al3+��Fe3+��CO32����SO42����NO3���еļ��֣���������п����������ɫ��ζ�������壻��������NaOH��Һ��������ɫ�������Ҳ����ij��������ʵ��������NaOH�����ʵ���֮��Ĺ�ϵ��ͼ��ʾ��������˵����ȷ���ǣ�������
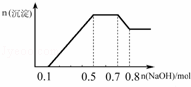
�� A�� ��Һ�е�������ֻ��H+��Mg2+��Al3+
�� B�� ��Һ��n��NH4+��=0.2mol
�� C�� ��Һ��һ������CO32�������ܺ���SO42����NO3��
�� D�� �������ӵ����ʵ���֮��n��H+����n��Al3+����n��Mg2+��=1��1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijδ֪��Һ���Ѽ������������Ca2+��NO3������pH=2�����������Һ���Ƿ������������6�����ӣ���ClO�� ��NH4+��I����Fe2+��AlO2����Cl�������в��ؼ�������ų��������ǣ�������
�� A�� �ڢۢݢ� B�� �٢ۢܢ� C�� �٢ܢݢ� D�� �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ���ܺ���Cl����SO42����CO32����NH4+��Fe3+��Al3+��K+�е����ֻ���֣�ȡ����Һ100mL���������NaOH��Һ�����ȣ��õ�448mL����������壬ͬʱ�������ɫ�����������ˡ�ϴ�ӡ����գ��õ�1.6g���壻��������Һƽ���ֳ����ݣ�һ���м�����BaCl2��Һ���õ�2.33g����������ij�������һ����ͨ�����CO2�õ�1.56g��ɫ�������ɴ˿��ƶ�ԭ��Һһ�����е��������༰��Ũ�ȣ�����������±����ɲ���������
һ�����е��������� ���� ���� ����
���ʵ���Ũ�ȣ�mol/L�� ���� ���� �� ���� ���ݡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ɫ��Һ�п��ܺ���Na+��Ba2+��Cu2+��CO32����Cl����Mg2+�е�һ�ֻ������ӣ�
�������Һ�еμ�����ϡ��������������
��ȡ�����ٵ���Һ������������Na2SO4��Һ���а�ɫ����������
��ȡ�ڵ��ϲ���Һ������������NaOH��Һ���а�ɫ����������
��1��ԭ��Һ��һ�����е�������������һ�������е�����������������ȷ���Ƿ��е�����������
���з�Ӧ�����ӷ���ʽΪ������
��3������ȡ10mL�ٵ���Һ����ƿ�У�Ȼ�������Һ����μ���NaOH��Һ����ͼ����ʾ�����μӹ����в������������������NaOH��Һ������Ĺ�ϵ��ͼ����ʾ��
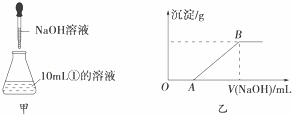
��OA�η�Ӧ�����ӷ���ʽΪ��������AB�η�Ӧ�����ӷ���ʽΪ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1�����飨SiH4����һ����ɫ���壬���������ܷ�����ը����ȼ������SiO2��ˮ��������֪������1g������ȼ�ų�����44.6kJ�����Ȼ�ѧ����ʽ�� ��
��2��ʹCl2��H2O��g��ͨ�����ȵ�̿�㣬����HCl��CO2�Ƿ��ȷ�Ӧ����1mol Cl2���뷴Ӧʱ�ͷ�145kJ��������д������Ȼ�ѧ����ʽ�� ��
��3������Һ�����е���Ҫ�ɷ�֮һ�Ƕ��飬��10kg������ȫȼ�ղ�����CO2��Һ̬ˮʱ���ų���������5��105 kJ����д������ȼ�յ��Ȼ�ѧ����ʽ�� �������ȼ����Ϊ kJ•mol﹣1����֪1molҺ̬ˮ����ʱ��Ҫ����44kJ����������Ӧ��C4H10��g��+ O2��g��═4CO2��g��+5H2O��g���ġ�H=﹣ kJ•mol﹣1�����¸�ѹ����N2��g��+3H2��g�� 2NH3��g������H��0��
O2��g��═4CO2��g��+5H2O��g���ġ�H=﹣ kJ•mol﹣1�����¸�ѹ����N2��g��+3H2��g�� 2NH3��g������H��0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ƻ���к��е��ۡ������Ǻ����εȣ�ij������ȤС�������һ��ʵ��֤��ijЩ�ɷݵĴ��ڣ�������벢Э������������ʵ�飮
��1����С�Թ�ȡ������ƻ��֭����������Cu��OH��2����Һ�������ȣ�����ש��ɫ�ij�������ƻ���к���������д����ʽ����
��2����������һ�������¿��Եõ���ѧʽΪC2H6O�Ļ�����A��A+CH3COOH������ζ�IJ����A���������Ϊ75%��ˮ��Һ��������������
��3��ƻ���к���ƻ���ᣬ�������Է�������Ϊ134��ȡ0.02molƻ���ᣬʹ����ȫȼ�գ���ȼ�պ�IJ����Ⱥ�ͨ����������ˮCaCl2�ͼ�ʯ�ң����߷ֱ�����1.08g �� 3.52g���������C��Hԭ�ӵĸ���������ƻ����ķ���ʽ��������
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com