
A. 与足量Fe反应转移电子数一定为3NA 与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,22.4L NH3中含有共价键的数目为NA |
C.1.0L  的 的 水溶液中含有的氧原子数为3NA 水溶液中含有的氧原子数为3NA |
D.4.6g Na完全转化成 的混合物,混合物中阴离子总数为0.1NA 的混合物,混合物中阴离子总数为0.1NA |
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.15g甲基(-CH3)所含有的电子数是NA |
| B.常温常压下,4g氦气所含有的原子数目为NA |
| C.标准状况下,1L己烷充分燃烧后生成的气态产物的分子数为6/22.4 NA |
| D.常温常压下,1mol乙烷所含有的共价键数目为8NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,SO
,SO 的物质的量浓度是 。
的物质的量浓度是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.20 mL 2 moL/L Mg(NO3)2 |
| B.100 mL 2.5 mot/L NaNO3 |
| C.25 mL 1.0mol/L Al(NO3)3 |
| D.30 mL 2.5 mol/L NH4NO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | _________ | _________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,33.6L HF中含有氟原子的数目为1.5NA |
| B.常温常压下,9.2g二氧化氮和四氧化二氮的混合物含有氮原子的数目为0.2NA |
| C.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D.0.1mol铁溶于足量氯水中,转移电子的总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.n(烧碱)<n(稀硝酸)<n(盐酸) | B.n(烧碱)<n(盐酸)<n(稀硝酸) |
| C.n(稀硝酸)<n(烧碱)<n(盐酸) | D.n(盐酸)<n(稀硝酸)<n(烧碱) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处, 用胶头滴管加蒸馏水至刻度线。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.ng该氯原子所含的电子数为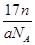 |
B.mg该氯原子的物质的量为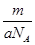 mol mol |
C.该氯原子的相对原子质量为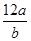 |
| D.0.5 mol该氯分子的质量为aNAg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com