氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作.
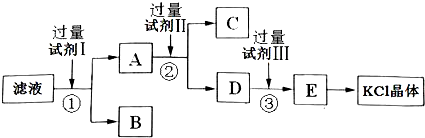
回答下列问题:
(1)检验滤液中的SO
42-的方法是
取少量滤液于试管中,向其中加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则有SO42-,反之则无
取少量滤液于试管中,向其中加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则有SO42-,反之则无
.
(2)试剂I的化学式为
BaCl2
BaCl2
,加入试剂I后,①对应的实验操作是
过滤
过滤
,①中发生反应的离子方程式为
Ba2++SO42-=BaSO4↓;,Ba2++CO32-=BaCO3↓
Ba2++SO42-=BaSO4↓;,Ba2++CO32-=BaCO3↓
.
(3)试剂Ⅱ的化学式为
K2CO3
K2CO3
,②中加入试剂Ⅱ的目的是
除去多余的Ba2+
除去多余的Ba2+
.
(4)试剂Ⅲ的名称是
盐酸
盐酸
,③中发生反应的离子方程式为
2H++CO32-=H2O+CO2↑
2H++CO32-=H2O+CO2↑
.
(5)某同学称取提纯的产品0.745g,溶解后定容在100mL容量瓶中,每次取25.00mL溶液,与0.1000mol?L
-1的硝酸银标准溶液反应,三次反应消耗硝酸银标准溶液的平均体积为23.50mL,该产品的纯度为
94%
94%
.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案