
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
| 0.4×0.4 |
| 0.2×(0.6)3 |
| 100 |
| 27 |
| c2(NH3) |
| c(N2)?c3(H2) |
| 100 |
| 27 |
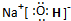 ,
,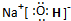 ;
;

科目:高中化学 来源: 题型:
| A、五种元素均能形成不同种同素异形体 | B、X和Y、W分别可以形成XY2、XW2化合物 | C、氢化物稳定性由强到弱的是:Q、W、Z、X | D、W形成简单阴离子半径小于Q形成简单阴离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素。
⑴W在周期表中的位置: 。
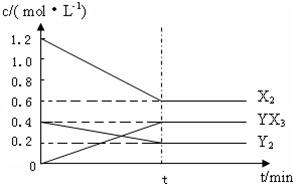
⑵在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2 (g) + Y2(g) 2YX3(g) △H 反应各物质的量浓度随时间变化如下:
①此反应的平衡常数表达式为 (用化学式表示) , K= 。
②若升高温度平衡常数K减小,则△H 0(填>,<)。
⑶A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol·L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为 。
⑷B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是 。
⑸A2和B1反应生成B2,则0.2mol/LA2和0.1mol/LB1等体积混合后溶液中离子浓度大小关系为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省长春市十一高中高一下学期期末考试化学试卷(带解析) 题型:填空题
(13分)已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素。
(1)W在周期表中的位置: 。
(2)在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2 (g) + Y2(g)  2YX3(g) △H
2YX3(g) △H
反应各物质的量浓度随时间变化如下:
①计算该温度下此反应的平衡常数K= 。
②若升高温度平衡常数K减小,则△H 0(填“>”、“<”或“=”)。
③改变下列条件,能使该平衡向正反应方向移动且平衡常数不变的是 (填字母)。
a.增大压强 b. 降低温度 c.使用催化剂 d. 增大反应物的浓度
(3)常见液态化合物X2Z2的稀溶液易被催化分解,可使用的催化剂为 (填字母)。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)A是四种元素中三种元素组成的电解质,溶液呈碱性,将常温下0.1mol·L-1的A溶液稀释至原体积的10倍后溶液的pH=12,则A的电子式为 。
(5)以X2为燃料可制成燃料电池。已知:2X2(g)+Z2(g)=2X2Z(l) △H=?572KJ·mol-1
该燃料电池释放228.8KJ电能时,生成1mol液态X2Z,该电池的能量转化率为 。
查看答案和解析>>
科目:高中化学 来源:2014届吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:填空题
(13分)已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素。
(1)W在周期表中的位置: 。
(2)在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2 ,发生如下反应:
3X2 (g) + Y2(g)
 2YX3(g) △H
2YX3(g) △H
反应各物质的量浓度随时间变化如下:

①计算该温度下此反应的平衡常数K= 。
②若升高温度平衡常数K减小,则△H 0(填“>”、“<”或“=”)。
③改变下列条件,能使该平衡向正反应方向移动且平衡常数不变的是 (填字母)。
a.增大压强 b. 降低温度 c.使用催化剂 d. 增大反应物的浓度
(3)常见液态化合物X2Z2的稀溶液易被催化分解,可使用的催化剂为 (填字母)。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)A是四种元素中三种元素组成的电解质,溶液呈碱性,将常温下0.1mol·L-1的A溶液稀释至原体积的10倍后溶液的pH=12,则A的电子式为 。
(5)以X2为燃料可制成燃料电池。已知:2X2(g)+Z2(g)=2X2Z(l) △H=−572KJ·mol-1
该燃料电池释放228.8KJ电能时,生成1mol液态X2Z,该电池的能量转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com