
科目:高中化学 来源:2016-2017学年河北省高二下学期3月月考化学试卷(解析版) 题型:选择题
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图:

则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为
A. 2 B. 3 C. 4 D. 6
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期期中考试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,Y原子在周期表中处于族序数等于周期序数3倍的位置,Z是最外层电子数最少的金属元素,W与Y属于同一主族。下列叙述正确的是
A. 原子半径:W>Z>Y
B. 元素W最高价氧化物的水化物为强酸
C. 化合物X2Y、Z2Y中化学键的类型相同
D. 元素Y的简单气态氢化物的热稳定性比W的弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期期中考试化学试卷(解析版) 题型:选择题
2016年朝鲜进行氢弹实验.引起国际社会的极大关注。下列关于 的说法正确的是
的说法正确的是
A. 质量数是1 B. 质子数是2 C. 中子数是2 D. 电子数是1
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(一)化学试卷(解析版) 题型:填空题
氢氧化镁是已知用途广泛、极具开发前景的环保材料,广泛应用在阻燃、废水中和、烟气脱硫等方面。镁硅酸盐矿石[主要成分Mg3Si2O5(OH)4,含氧化铝、氧化铁、氧化亚铁等杂质]可用于生产氢氧化镁,简要工艺流程如下:

已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)对矿石焙烧的目的是_______________________。
(2)加入H2O2溶液反应的离子方程式是___________________。
(3)向溶液Ⅰ中加入的X可以是______________,作用是______________。
(4)加入氨水时,Mg2+转化率随温度t的变化如图所示:

①溶液Ⅱ中发生反应的离子方程式是__________________。
②t1前Mg2+转化率增大的原因是__________________;t1后Mg2+转化率下降的原因是(用化学方程式表示)______________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(一)化学试卷(解析版) 题型:选择题
下列有关物质的性质与用途具有对应关系的是
A. 碱石灰具有吸水性,可用于干燥氯气
B. 甲醛能使蛋白质变性,可以用于食品防腐剂
C. 炭具有强还原性,常用于冶炼钠、钾等金属
D. 碳酸氢钠溶液具有弱碱性,可用于制胃酸中和剂
查看答案和解析>>
科目:高中化学 来源:2017届北京市朝阳区高三第一次(3月)综合练习理综化学试卷(解析版) 题型:选择题
某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一下学期第一次月考(3月)化学试卷(解析版) 题型:选择题
同一周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是
A. 原子半径:X>Y>Z B. 气态氢化物的稳定性:HX>H2Y>ZH3
C. 元素原子得电子能力:X>Y>Z D. 阴离子的还原性:Z3->Y2->X-
查看答案和解析>>
科目:高中化学 来源:2017届全国新课程高考仿真信息理综(一)化学试卷(解析版) 题型:简答题
化学反应原理在工业生产中有广泛的应用。
(1)工业合成氨气的氢气主要来自天然气与水的反应, 但这种原料气中含有CO杂质,工业生产中通过下列反应来实现原料气中CO的除去。
CO(g)+H2O(g) CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取_____措施可提高CO的转化率。在容积为2L的容器中发生上述反应,其中c(CO2)与反应时间(t)的关系如图甲所示,在t0时刻将容器体积扩大至4L,在图甲中画出t0时刻后。c(CO2)与反应时间(t)的变化曲线_____。
CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取_____措施可提高CO的转化率。在容积为2L的容器中发生上述反应,其中c(CO2)与反应时间(t)的关系如图甲所示,在t0时刻将容器体积扩大至4L,在图甲中画出t0时刻后。c(CO2)与反应时间(t)的变化曲线_____。

(2)氨气的重要用途是合成尿素. 当加料比n(NH3)/n(CO2)=4时,CO2的转化率变化如图乙所示,a点v(CO2)逆______点v(CO2)正(填“大于”、“小于”或“等于”)。NH3的平衡转化率是______。
(3)某科研小组利用CO和H2在密闭容器中反应合成甲醇的实验,容器的开始体积是VL,实验中向容器中加人CO nmol, H22nmol,在一定的压强和催化剂的作用下反应:CO (g)+ 2H2(g) CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。
CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。
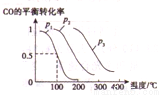
①上述合成甲醇的反应是______(填 “吸热”或“放热”)反应,图像中的压强p1、p2、p3的大小关系是_______。
②由图像分析压强p1温度是100℃时合成甲醇反应的平衡常数K=_______。
③在压强是p1温度是100℃的条件下,开始若向容器中加入CO 2nmol,H24nmol,反应达到平衡时CO的转化率_____(填“变大”、“变小”或“不变”),平衡时CO的物质的量_____(填“大于”、“小于”或“等于”)nmol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com