
下列实验现象预测、实验设计、仪器使用能达到目的是( )

A. 模拟工业制氨气并检验产物

B. 实验室采用所示装置收集SO2
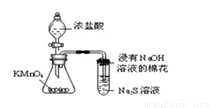
C. 可用所示装置比较KMnO4、Cl2、S的氧化性强弱
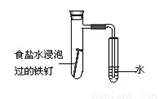
D. 可用所示装置验证铁发生析氢腐蚀
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源:2017届云南省高三高考适应性月考(六)理综化学试卷(解析版) 题型:选择题
下列实验操作或事实能达到预期实验目的的是
选项 | 实验目的 | 实验操作或事实 |
A | 温室下比较NaHCO3和Na2CO3的溶解度 (已知20℃时溶解度:NaHCO3为9. 6g; Na2CO3为21.8g) | 向5mL蒸馏水中分别加入10g的NaHCO3、Na2CO3 ,观察溶解情况进行比较 |
B | 检验某卤代烃不含溴元素 | 取少量卤代烃,滴加AgNO3溶液,无浅黄色沉淀产生 |
C | 验证HClO4与H2SO4的酸性强弱 | 将SO2通入含HClO溶液中生成H2SO4 |
D | 验证A12O3的熔点髙于A1 | 将铝箔放在酒精灯火焰上加热,铝箔融化但不滴落 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省揭阳市高二下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
下列实验能达到实验目的且符合实验设计要求的是( )
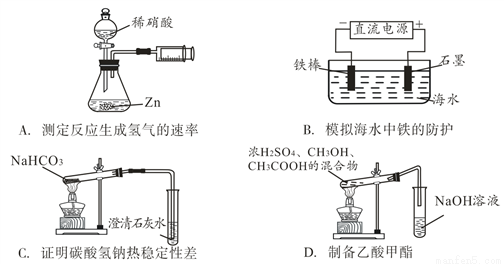
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届江西省、临川一中高三1月联考理综化学试卷(解析版) 题型:简答题
碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种应用前景广泛的新材料,实验室中可用甲醇、CO、CO2等进行合成。回答下列问题:
(1)二氧化碳的电子式为 _________________
(2)用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC。
已知:①CO的标准燃烧热为:?283.0kJ•mol?1,
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
③2CH3OH(g)+CO2(g)?CH3OCOOCH3(g)+H2O(g)△H=?15.5kJ•mol?1
则2CH3OH(g)+CO(g)+1/2O2(g)?CH3OCOOCH3 (g)+H2O(l)△H=_____。
该反应在常压和70~120℃条件下就能自发反应的原因是_______________。
(3)由上述反应可知甲醇和CO2可直接合成DMC但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
①写出该反应平衡常数表达式:______________ ;
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是____(选填编号).
A.v正(CH3OH)=2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10?5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图1所示.(计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量)。

在该温度下,最佳反应时间是_________h;4~10h内DMC的平均反应速率是_______ .
(4)以多孔铂为电极,在如下图装置中A、B口分别通入CH3OCOOCH3和O2构成燃料电池,请写出该电池负极的电极反应式____________________________
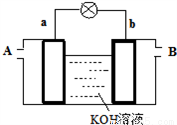
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:填空题
在5-氨基四唑(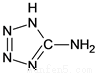 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子的电子排布式可表示为__________;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为__________;在1mol 5-氨基四唑中含有的σ键的数目为__________.
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为__________.

②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化 钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如图示)顶点的氮原子,这种碳氮化钛化合物的化学式为__________.
③[Ti(OH)2(H2O)4]2+中的化学键有__________.
a.σ键 b.π键 c.离子键 d.配位键.
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
25℃时,下列溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol·L-1NaHC2O4溶液(pH=5.5):c(Na+)> c(HC2O4-)> c(H2C2O4)> c(C2O42-)
B. 0.1mol·L-1NaHS溶液:c(OH-)+ c(S2-)= c(H+)+ c(H2S)
C. 0.1mol·L-1CH3COOH溶液和0.1mol·L-1CH3COONa溶液等体积混合:c(Na+)> c(CH3COOH)> c(CH3COO-)> c(H+)> c(OH-)
D. 0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液至中性:c(Na+)> c(SO42-)>c(NH4+)> c(OH-)= c(H+)
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:计算题
向130mL某浓度的硫酸溶液中加入一定量的铜片,在微热条件下反应,待铜片完全溶解,冷却后将溶液稀释至500mL,再加入过量铁粉,使之充分反应,生成的气体在标况下的体积为16.8L;过滤得到残留固体,经干燥、称量,比原铁粉质量减轻了35.6g。
(1)与硫酸铜反应的铁的质量为_________g。
(2)原浓硫酸的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
在给定的条件下,下列选项所示的物质间转化均能实现的是
A. H2SiO3 SiO2
SiO2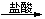 SiCl4 B. 浓HCl
SiCl4 B. 浓HCl Cl2
Cl2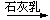 漂白粉
漂白粉
C. Fe Fe2O3
Fe2O3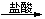 FeCl3 D. Mg(OH)2
FeCl3 D. Mg(OH)2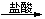 MgCl2(aq)
MgCl2(aq) 无水MgCl2
无水MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com