
【题目】0.1mol/LCH3COOH溶液加水稀释或升高温度的过程中,下列表达式的数值一定变大的是
A. c(H+) B. c(H+)·c(OH-) C. ![]() D.
D. ![]()
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,下列描述错的是( )
A.AlON和石英的化学键类型相同B.电解熔融AlON可得到Al
C.AlON的N元素化合价为﹣1D.AlON和石英晶体类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。
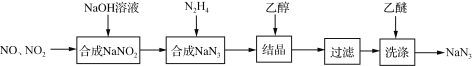
(1)NO和NO2混合气体与NaOH溶液反应可以合成NaNO2,写出该反应的化学方程式___,生成1mol NaNO2时转移电子______mol
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为______和______,1mol该阴离子中所含的电子总数为______mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56 L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56 L。
①该反应中的氧化剂为______还原剂为______(填化学式)
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克______?(写出计算过程,保留一位小数,不考虑固体的体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如图所示,其中不正确的是
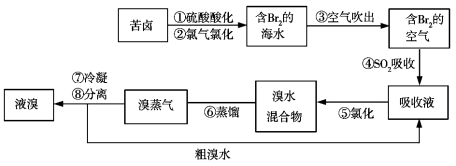
A.步骤④⑤是为了富集溴
B.步骤③说明溴具有挥发性
C.步骤④的离子方程式为Br2+SO2+H2O![]() 2H++2Br-+SO32-
2H++2Br-+SO32-
D.步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | M层上有6个电子 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
用相应的元素符号或化学式回答以下问题
(1)元素X的一种同位素中子数比质子数多1,这种同位素的符号是______。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式______。
(3)元素Z与元素T相比,非金属较强的是______(用元素符号表示)。
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中酸性最强的是______(化学式)
(5)T的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:
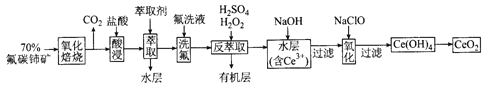
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
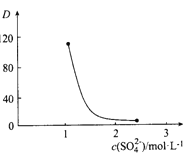
(3)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中不正确的是
A. 某密闭容器中盛有0.2 mol SO2和0.1 mol O2,一定条件下充分反应,生成SO3分子数小于0.2 NA
B. 一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1 NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为 0.1 NA
D. 20g D2O中含有的质子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)① _____③______⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式________,用电子式表示其形成过程为__________。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是: ______﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com