
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A |
| Zn保护了Fe不被腐蚀 |
B |
| 2NO2(g)N2O4(g)为吸热反应 |
C |
| 木炭与浓硝酸发生了反应 |
D |
| 碳酸钠的水解程度强 |
A.AB.BC.CD.D
【答案】A
【解析】
A.只有Fe的实验中,加入K3[Fe(CN)6],得到蓝色沉淀,说明Fe被腐蚀,生成了Fe2+;Zn-Fe原电池的实验中,取Fe电极附近的溶液,加入K3[Fe(CN)6],没有得到蓝色沉淀,说明Fe没有被腐蚀,Zn保护了Fe不被腐蚀,故A正确;
B.热水中颜色深,可知升高温度,2NO2(g)N2O4(g)逆向移动,则正反应为放热反应,故B错误;
C.浓硝酸受热也可分解生成二氧化氮,不能说明木炭与浓硝酸发生了反应,故C错误;
D.比较两种离子的水解程度,需要使用相同离子浓度的溶液;室温下,碳酸钠的溶解性比碳酸氢钠大,则二者的饱和溶液中,两种物质的浓度不同,对应的阴离子浓度也不相同,因此本实验不合理,故D错误;
答案选A。


 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
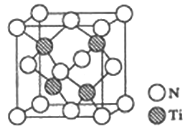
【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
(1)在基态Ti原子中,核外存在_____对自旋相反的电子,核外电子占据最高能层的符号是___,占据该能层电子的电子云轮廓图形状为____。
(2)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2 ![]()
![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有_______;反应中涉及的元素中电负性最大的是______。 三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________。
,该反应中涉及的物质中碳原子的杂化轨道类型有_______;反应中涉及的元素中电负性最大的是______。 三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________。
(3)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____(填元素符号);配体之一H2O2分子中氧原子的价层电子对互斥模型是___。
(4)科学家通过X射线探明一种氮化钛的晶体与NaCl的晶体结构相似。氮化钛熔点(2950℃)比氯化钠的高,主要原因是________________。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为_____。已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长为____cm(用含ρ、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式_____________
(2)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态:①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是_________(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(3)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是____。
②O3分子的中心原子杂化类型为______;与O3互为等电子体的是______(任意写一种)。
(4)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl 2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(5)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dg·cm3。

①Na3OCl晶胞中,O位于各顶点位置,Cl位于______位置。
②用a、d表示阿伏加德罗常数的值NA=_____(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 和
和![]() 制备
制备![]() 的原理为:
的原理为:
①![]()
②![]()
已知:A、B均为有机物,两个反应均能自发进行;NA代表阿伏加德罗常数。下列说法正确的是
A.B为![]() 和
和![]() 制备
制备![]() 的催化剂
的催化剂
B.1mol![]() 与足量的B在一定条件下发生反应②,共转移2NA个电子
与足量的B在一定条件下发生反应②,共转移2NA个电子
C.反应①的反应物的总能量大于产物的总能量
D.标准状况下,22.4L![]() 含NA个分子
含NA个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1molL-1NaOH溶液滴定20mL0.1molL-1CH3COOH溶液,溶液的pH随加入NaOH溶液体积的变化如图。下列说法不正确的是( )
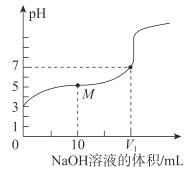
A.0.1molL-1CH3COOH溶液中,由水电离出的c(H+)<10-7molL-1
B.V1<20
C.M点溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.二者等体积混合时,c(Na+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究金属锌与氯化铜溶液之间反应,在实验中该同学观察到的现象有:
i.产生少量气泡;ii.有红色固体生成;iii.溶液中产生白色沉淀。
为了解释上述现象,某同学查阅资料,获得如下信息:
编号 | 化学反应离子方程式 |
1 | Zn+Cu2+ |
2 | Zn+2Cu2+ |
3 | Cu++2Cl- |
4 | Cu++Cl- |
(1)请结合离子方程式解释产生少量气泡的原因:___。
(2)Zn与CuCl2反应生成白色沉淀的离子方程式是___。
(3)为了探究影响生成白色沉淀的因素,该同学进一步实验。取不同浓度CuCl2溶液,加入锌并振荡,均立刻产生少量气泡和红色固体,其他实验现象如下。
| 编号 | 浓度(rnol/L) | 试剂(锌均过量) | 实验现象 |
a | 0.5 | 锌片 | 立刻出现少量白色沉淀 | |
b | 1 | 锌片 | 立刻出现白色沉淀 | |
1 | 锌粉 | 立刻出现大量白色沉淀 | ||
d | 1 | 锌片、适量NaCl固体 | 少量白色沉淀,振荡迅速溶解 |
①对比实验a、b,实验结论是___。
②某同学从化学平衡的角度分析,d中白色沉淀溶解可能的原因是___(用离子方程式表示)。为证明该同学分析的原因正确,向b试管中加入适量___,振荡,观察到___,证明该同学分析的原因正确。
(4)利用沉淀法除去杂质在实际生产中应用广泛。
①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入___和___,生成沉淀而除去。
②通过进一步查阅资料得知:CuCl的形成与溶液的pH及Cu2+等离子浓度有关,一定条件下,通过实验得出pH、Cu2+浓度对Cl-沉淀的影响如图所示:

根据图,除去该电解液中Cl-的最佳条件是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C6H12的烃有多种同分异构体,对于其中主链上有4个碳原子且只有一个支链的烯烃,下列说法不正确的是( )
A.该烃的名称为2—乙基—1—丁烯
B.该烃与氢气发生加成反应得到的烷烃的名称为3-甲基戊烷
C.该烃能使溴的四氯化碳溶液褪色,不能与溴发生取代反应
D.该烃能在一定条件下与HCl发生加成反应,得到两种卤代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AlH3。下列说法正确的是( )
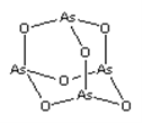
A.As2O3分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物,含有配位键
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于109.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.将装有NO2的玻璃球浸入热水中颜色加深:2NO2(g)![]() N2O4(g) ΔH>0
N2O4(g) ΔH>0
B.用Na2S处理含Hg2+废水:Hg2++S2-=HgS↓
C.Na2S2O3溶液与稀H2SO4混合产生浑浊:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
D.闪锌矿(ZnS)经CuSO4溶液作用转变为铜蓝(CuS):ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com